ER/ES実践について研究するページです。
*万が一文中に解釈の間違い等がありましても、当社では責任をとりかねます。
本文書の改訂は予告なく行われることがあります。
製薬協EDC自主ガイダンスの考察(その1)
1. はじめに
前号でも紹介したとおり、日本製薬工業協会 医薬品評価委員会は、2007年11月1日、臨床試験データを電子的に取得する場合の具体的な要件を示すことを目的に「臨床試験データの電子的取得に関するガイダンス」(以下、ガイダンス)と呼ばれる自主ガイダンスを発行した。
症例報告書(以下、CRF)を電子化する場合、これまでの紙媒体のCRF(以下、紙CRF)と同等の品質および品質保証を確保する必要がある。
EDCは治験の生データである症例データを電子的に取得するものであり、ERESガイドラインの適用を受ける。
ガイダンスは、ERESガイドラインを具体的にEDCに適用させたものである。
しかしながらガイダンスは、いくつかの用語が定義されないまま使用されていたり、本来の用語の意味と多少解釈の違う点が見られる。また真正性、見読性、保存性の区別が多少入り乱れている個所も見受けられる。
本稿では、ガイダンスの内容を筆者なりに考察してみたい。
2. 電子症例報告書を原本とすることができる要件
ガイダンスの第4章は、「臨床試験データを電子的に取得するための要件」であり、「4.1. 実施医療機関で入力されるデータについての要件」と「4.2. 中央検査機関から電子的に入手するデータについての要件」に分かれている。
| 4. 臨床試験データを電子的に取得するための要件 4.1. 実施医療機関で入力されるデータについての要件 ERESガイドラインに従い、以下に述べる要件(4.1.1.~4.1.3.1.)を満たせば、EDCシステムを用いて治験責任医師、治験分担医師(以下「治験責任医師等」と言う)及び治験協力者が入力し(手入力及び記録媒体を介して実施医療機関内の一部の電子データを取り込む場合を含む)、EDC サーバー上に格納されたデータを電子症例報告書原本とすることができる。 原本には、治験責任医師等の評価を含む入力データ、修正履歴、電子署名情報(電子署名を使用した場合)を含む。 EDC サーバーからのデータ移管後は、移管するまでのデータが要件4.1.1~4.1.3.1 を満たし、かつ、「4.1.3.2. データ移管後の保存用症例報告書の保存性に関する要件」を満たせば、サーバー上のデータを他の媒体に保存したものを原本とみなすことができる。 |
このセクションを読む限り、本ガイダンスは、電子症例報告書(以下、eCRF)を原本とすることができる要件を記載していると読める。しかしながら、これまでのように紙CRFをEDCシステムを利用して作成する場合にも適用するべきであると考える。
電子症例報告書原本は、ASPサービス利用中(つまり治験実施中)は、サーバー上のデータベースにあり、ASPサービス終了後(つまり治験終了後)にはCD-R等の電磁的記録媒体にpdf等のフォーマットで出力され管理される。(図1 参照)
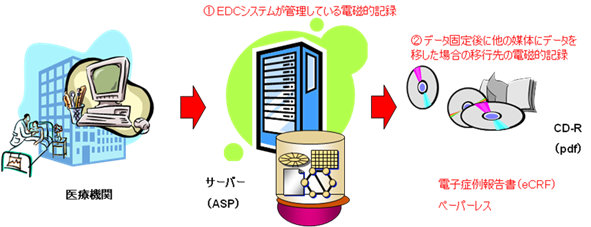
図1 電子症例報告書原本
| ただし、電子症例報告書原本は、EDCシステム稼動中及びEDC サーバーからのデータ移管後の各段階で、予め定義・特定されていなければならない。 |
規制当局は、いかなる時点においても臨床試験データを査察することがあるので、EDC利用に際しては、時系列的にどの電磁的記録が「電子症例報告書原本」であるかをプロトコール(またはSOP)で定義しておく必要があるのである。
3. コンピュータシステムバリデーション
| なお、使用するEDCシステムはコンピュータシステムバリデーション(Computerized System Validation 以下CSV)ポリシーに則ったCSVによりシステムの信頼性が保証されていることが前提であり、以下の点に留意する。 |
「CSVポリシー」とは、製薬企業各社が作成しているCSVに関する手順書等の文書のことであると理解する。
現在、日本の規制当局からはCSVに関するガイドラインが出されていない。
多くの製薬企業では、GAMP等に従って、CSVの手順書等を作成しているものと思われる。
EDCシステムをASPサービスとして利用する場合、当該システムの品質保証は、その多くを当該ベンダーが実施しているべきである。ベンダーの多くは自社のQMS(品質管理システム)を文書化しているはずであり、それらに則った品質保証が実施されていることを期待する。
EDCを利用する製薬企業は、当該ベンダーを事前に監査しておかなければならない。またユーザ受入れテスト(UAT)を実施し、要求仕様を満たすことを確認しておく必要がある。
| CSVには開発・導入段階のみならず、システムの運用段階、システムの改訂段階、及びシステムの廃棄段階における手順等も含める。 |
このパラグラフは、CSV SOPの作成に関する注意事項であると読める。
システムの運用段階で重要なことは、当該システムがバリデーション状態を維持していることを保証することである。そのためには、運用段階における障害管理及び変更管理の手順を定めておかなければならない。
システムの改訂とは、当該ソフトウェア等のバージョンアップ等を指すと考えられる。改訂も変更管理に従って実施しなければならない。
システムの廃棄段階で重要なことは、 当該症例データのみならず、監査証跡、電子署名の情報を別のシステム等に移行しておかなければならない。
CSV実施で重要なことは、文書化された証拠つまり記録を作成し適切に保存しておくことである。
| 治験依頼者は、当該システムで作成された資料を保存する必要のある期間、当該EDCシステムに適用されているCSVポリシー及びプロセスを説明でき、かつCSV報告書等必要な資料を用意できるようにしておく。 |
規制当局の査察等が行われた際には、CSV SOP等を提示し、説明できることが肝心である。
CSV報告書とは、CSV SOP等に従って作成したCSVの実施記録のことであると理解する。CSVの記録は適切に保存しておかなければならない。これら必要な資料は、すみやかに提示できるようにしておかなければならない。
| ベンダー、CROに委託した業務の品質に対しても依頼者が保証する責任がある。 |
EDCベンダーやASPベンダーは、当該システムの品質保証を行う義務がある。またCRO等は、品質が保証されたEDCシステムを利用し、その治験実施のプロセスの品質を保証し、また当該治験における症例データ(電磁的記録)等の品質を保証する義務がある。
製薬企業は、当該EDCシステムについて、それらベンダーが自社のQMS等に従って品質保証していることを、ベンダーオーディット等を通じて事前に確認しておかなければならない。
また治験実施中においても、CRO等が品質計画を守って活動し、症例データが適正に取得され保存されていることを常にモニタリングしなければならない。
ベンダーやCRO等に対して、ベンダーオーディット等を実施する際には、本ガイドラインに従ってチェックリスト等を作成し、要件を満たすかどうかを調査しておくことが望まれる。
4. 電磁的記録の真正性に関する要件
| 4.1.1. 電磁的記録の真正性に関する要件 1) 使用するEDCシステムは、利用者の責任に応じた権限を付与でき、付与された権限に基づき意図したデータが正しく入力される仕組みになっている。ユーザ管理と権限設定が、事前に設定した規則に基づき適切に行われている。 システムアクセス時の本人性が確保されている(ID、パスワード等の適切な運用)。 |
真正性とは、当該記録が本物であり、記録の作成者自身が入力または修正しており、主張通りの時刻に作成されていることを言う。
真正性を確保するためには、セキュリティや監査証跡等の機能要件と、当該システムをルールに従って適正に利用するといった運用要件の両方を検討しなければならない。
ユーザを管理する際には、あらかじめ決められたルールに従って、権限設定を適切に行わなければならない。権限設定とは、入力権限、修正権限、削除権限、承認権限等である。
権限は必要なユーザに最低限で設定するべきで、不要になった際にはすみやかに抹消しなければならない。
パスワードは決して他人に漏らしてはならない。システムがセキュリティ機能を持っていても、運用する者がルールを守らない限り、その信頼性は確保できない。
| 教育訓練により適正運用され、コンプライアンスの確保がなされている(例、なりすまし、パスワードの盗用等の防止)。 |
治験責任医師、分担医師、治験協力者等へ、ID、パスワード等を適切に運用するよう、教育研修を行い周知徹底しておかなければならない。
なりすましとは、本人ではないものがパスワードを盗用して、あたかも本人であるかのように入力・修正等を行ってしまうことである。
教育研修において、EDC運用中にセキュリティを侵害するような事態があった場合には、すみやかに報告義務があることなどを説明しておかなければならない。
また教育研修を実施したことをモニタリング報告書等で記録し、証拠としておくことが望ましい。
| 入力したデータが、意図したとおりに正確に記録される。入力したデータをディスプレイ画面などで確認できる。監査証跡を自動的に残すことができる(即ち、入力済みのデータを消去することなく修正が可能でデータ修正の記録をデータ入力者・修正者が識別される改変不可能なログとして自動的に残すことができる)。監査証跡は何人も改変することができない記録である。 |
上記の機能要件は、事前(すなわちASP契約前)にチェックしておかなければならない。
またCSVを徹底し、上記要件を検証しておかなければならない。
監査証跡は、規制当局等が改ざんの有無を調査するために必要で、自動的に記録されなければならない。
監査証跡自体が改変されれば、電磁的記録の真正性が確保できないことになる。規制当局にとって、監査証跡は“最後の砦”である。
| 記録媒体を介して実施医療機関内の一部の電子データを取り込む場合、治験依頼者は受け渡されるデータの信頼性・品質保証に関する責任範囲を契約等に明示し、またデータの信頼性を確認するなど品質の確保を図る。 治験依頼者は、契約等で合意された品質管理に関する事項が実施医療機関において遵守されていることを確認する。治験依頼者は、提供されるデータを点検し、品質に問題がないか確認する。 |
信頼性・品質保証とあるが、信頼性は品質保証の一部である。
ちなみに品質保証は英語でQuality Assuranceであり、信頼性はReliabilityという。Integrity(完全性)も品質保証上、重要な要件である。
| 2) EDCシステム及び運用手順において、セキュリティが確保されている。監査証跡から、データ入力者・修正者、入力・修正内容、入力・修正時期が調査できる。改ざん、漏洩、システム操作事実の否認を防止する仕組みがある。不正アクセスを防止する仕組みがある(マルウェア対策、ID・パスワード管理と流出防止、ユーザ管理、セキュリティホール対策等)。不正アクセスを検出する仕組みがある(アクセス状況のモニター、アラートをする仕組み、システム管理者によるアクセスログの確認等)。 |
これら機能要件においても、事前(すなわちASP契約前)にチェックし、CSVを徹底しておかなければならない。
| 信憑性、真実性、また必要に応じて秘密性を保証する技術が適用されている。 |
インターネット等を利用し、複数のサーバーを経由している途中で、データを盗み見られたり、差し替えられないように、SSL(セキュア・ソケット・レイヤー)や、VPN(仮想プライベートネットワーク )のような暗号化通信技術の利用が必須である。
| 3) GCPの下、紙症例報告書を利用して臨床試験データを収集した場合と同じレベルの品質が、電子症例報告書作成プロセスの運用、管理により確保されている。GCP等、他の法的要件を満たしている。原資料のあるデータについては、治験依頼者のSDVによりデータの一致性が確認されている。 |
電子化の原則は、紙ベースのオペレーションが電子化された際に、データの品質および品質保証が劣化してはならないということである。
| 電子症例報告書が原資料となるデータについては、EDCシステムでの権限設定による入力制御により、治験責任医師等のデータ作成者が明確になるように予め方策を講じておく。方策として運用手順を併用する場合、原資料とする部分を治験実施計画書等で特定し、その部分のデータの作成、修正の方法等について説明する文書を予め作成しておく。ただし、システムでの入力制御を運用手順で補完する場合は、データの品質管理上、信頼性の低下が危惧されるため、予め定められた運用手順通りのプロセスが実施されたことを併せて保証する必要がある。 |
電子症例報告書が原資料となるデータとは、カルテ等に記載しないデータのことである。紙CRFでも同様であるが、あらかじめプロトコール等に記載しておかなければならない。
電子症例報告書が原資料となるデータの場合、SDV等で信頼性を保証する手立てがない。
「システムでの入力制御を運用手順で補完する場合」とあるが、おそらく権限設定機能が不十分なEDCシステムを指しているものと思われる。そのようなシステムを利用することは控えるべきである。
| 治験依頼者は、紙症例報告書と同様に電子症例報告書の写しを治験責任医師に電子情報として提供し、保存されていることを確認する(注:EDCシステム撤去後の治験依頼者側による改ざんの抑止となる)。 |
GCPでは、治験責任医師が自ら症例報告書の写しを作成し、原本を治験依頼者に提出することになっている。
EDCを利用した治験の場合は、eCRFを治験依頼者が先に入手することになるので、製薬会社が写しを作成し、治験責任医師に提供することとなる。
具体的には、CD-R等のメディアにeCRFをpdf形式でコピーし提供することになる。
pdf形式を利用する理由は、見読性を確保するためである。
CD-R等のメディアは、経年劣化するという問題がある。紙CRFの場合は、ほぼ永久に保存できる。しかしながら、CD-Rは、直射日光をあてたり、割ったり、高温多湿状態で保管した場合、読みだすことができなくなる危険性がある。
したがって、医療機関に対し、保存性確保のための手順書(取り扱い方、保存環境等)を交付しておくことが望ましい。
さらにCD-Rの破損時の交換が可能なように、コピーを依頼者側でも保管しておかなければならない。
| ■治験責任医師が保存する電子症例報告書の写しは、以下の要件を満たしている。サーバー上のデータ(原本)から、無変換又は検証された自動変換の方式により出力されたものである。原本と比較可能な真正性及び見読性のあるコピーである。どの時点の原本から作成された写しであるか特定できる。実施医療機関において症例報告書のデータが、予め定められた保存期間中はいつでも、規制当局が調査できる、あるいは治験責任医師等がレビューできる。 |
eCRFの写しを作成する際は、手作業をはさまず、無変換又は検証された自動変換の方式により出力されなければならない。これは写しが正確であることを保証するためである。
「予め定められた保存期間中」とは、GCP上の必須文書の保存期間を指すものと思われる。
規制当局が調査できるためには、ドライブと当該バージョンを読み出せるソフトウェアが医療機関に必要となる。
| 症例報告書の作成の記録及び治験責任医師の署名については、以下のように運用されている。署名・印影一覧表に相当するものとして、個人ごとの権限を記載したアカウント管理表を作成・運用する。 |
アカウント管理表は、署名・印影一覧表に相当する。(図2 参照)
アカウント管理表は、適宜更新する必要がある。ただし、何らかの事情でユーザでなくなった場合でも、ユーザ登録を削除してはならない。その場合は、アクセス権限を削除し、ログオンができないようにする必要がある。
| 医療機関名 | 職位 | 氏名 | アカウント | eMail/TEL | 権限 | 備考 |
図2 アカウント管理表
| GCP 第47 条第1 項及び第2 項で症例報告書作成、変更又は修正の際に必要とされている記名捺印又は署名に関して、EDC を用いる場合は以下のとおりに対応する。電子データの入力者の特定ができるよう、入力日時及び入力者のログ(監査証跡)を残す。個々のデータに対して入力の度に「記名捺印又は署名」に相当するものが必要ということではない。全てのデータに対して入力者が特定される必要がある。治験責任医師は作成、変更又は修正した電子症例報告書の内容を点検・確認し、署名(電子的あるいは記名捺印又は手書き署名)する。 |
すべてのデータは、入力者および入力日時が監査証跡等で特定できなければならない。そのような機能をもったEDCを選択する必要がある。多くの場合は、CRCが入力することになると思われる。
ビジット毎の症例票に対して、治験責任医師または治験分担医師が電子署名を付すかどうかは、各社のSOPによって異なる。
症例毎にロジカルチェックが終了し、すべてのクエリーが解決され、コーディングが完了すれば、治験責任医師が電子署名を行うことになる。
紙CRFを原本とする場合は、治験責任医師は、印刷後すみやかに手書き署名または記名・捺印を行う必要がある。
| 報告書と対応する署名(記名捺印を含む)は一意に関係づけられている。治験責任医師は署名後にデータ変更のあった場合は変更後の内容について点検・確認し、署名(電子的あるいは記名捺印又は手書き署名)する。治験責任医師は監査証跡をディスプレイ画面等で確認できる。 |
電磁的記録を紙に印刷し、紙CRFに手書き署名または記名・捺印を行うといった、ハイブリッドシステムの場合、報告書と対応する署名(記名・捺印を含む)のリンクは困難である。
治験責任医師はeCRF、紙CRFともに、署名(記名・捺印を含む)を行う際は監査証跡を確認し、改ざん(意図しない変更)が行われていないことを確認して行わなければならない。
紙CRFには、監査証跡の情報が印刷されるEDCを選択しておくことが望ましい。
また監査証跡確認手順を、操作マニュアル等に記載しておく必要がある。
5. おわりに
EDCに見られるように、電子化の波は何人も止めることはできない。
21 CFR Part 11やERESガイドラインは、いわば規制緩和である。これまで書面で保存が義務つけられていた記録を、電磁的記録で保存しても良いとしたからである。
これまで電磁的記録は紙媒体の記録に比べて、データの品質および品質保証を劣化させてはならないとされてきた。しかしながら適切にバリデートされたコンピュータシステムは、紙媒体による記録よりも信頼性が高いといえるのである。
次号も引き続き、ガイダンスの考察を続けたい。
参考
- 「医薬品等の承認又は許可等に係る申請等における電磁的記録及び電子署名の利用について」平成17年4月1日 薬食発第0401022号
- 「臨床試験データの電子的取得に関するガイダンス」平成19年11月1日 日本製薬工業協会 医薬品評価委員会

Just want to say your article is as surprising.
The clarity in your post is just great and
i could assume you’re an expert on this subject.
Well with your permission let me to grab your feed to keep up to
date with forthcoming post. Thanks a million and please carry
on the rewarding work.
This technology could be particularly useful for companies that need to swiftly shift from prototype to full-scale production without sacrificing quality.
This technology could be highly useful for companies that need to rapidly
transition from prototype to full-scale production without compromising quality.
The combination of additive and subtractive processes in Mantle 3D is brilliant.
https://solo.to/kobet1
https://www.outlookindia.com/plugin-play/ED8590ED8590EBB2B3-EB8F99EC9DBC-EC8694EBA3A8EC8598-EBA994EC9DB4ECA080EC82ACEC9DB4ED8AB8-EBAAA8EC9584EBB3B4EAB8B0
https://shop.uaram.co.kr/shop/bbs/board.php?bo_table=free&wr_id=57266
http://sejonglb.com/bbs/board.php?bo_table=free&wr_id=345428
http://xn--bf0bzn517bbte8mq.kr/bbs/board.php?bo_table=free&wr_id=317400
http://jinos.com/bbs/board.php?bo_table=free&wr_id=548468
http://dchanwoo.com/gnu/bbs/board.php?bo_table=free&wr_id=763930
http://steduplex.blueaddlution.co.kr/bbs/board.php?bo_table=free&wr_id=269088
I think this is one of the most important information for me.
And i’m glad reading your article. But want to remark
on few general things, The web site style is great,
the articles is really nice : D. Good job, cheers
Hello There. I found your blog using msn. This is an extremely well written article.
I will be sure to bookmark it and return to read more of your
useful info. Thanks for the post. I will certainly return.
Hey There. I found your blog using msn. This is a really well written article.
I’ll make sure to bookmark it and return to read more of your useful information. Thanks for
the post. I’ll certainly comeback.
Hey There. I found your blog using msn. This is an extremely well written article.
I’ll be sure to bookmark it and come back to read more of your
useful info. Thanks for the post. I will definitely return.
Hi, i think that i saw you visited my web site so i came to
“return the favor”.I’m attempting to find things
to improve my site!I suppose its ok to use a few of your ideas!!
I’ve been browsing on-line more than three hours these days, but I
never found any attention-grabbing article like
yours. It’s beautiful price sufficient for me.
In my view, if all website owners and bloggers made good content material as you did, the internet shall be a lot more useful than ever before.
I was pretty pleased to discover this site. I wanted to thank you for
your time just for this wonderful read!! I definitely really liked every little bit of
it and I have you bookmarked to check out new stuff on your website.
Thank you for sharing your info. I really appreciate your efforts and I am waiting for your
further write ups thanks once again.
If you desire to obtain a good deal from this article then you have to apply such methods to your won blog.
First of all I would like to say terrific blog!
I had a quick question which I’d like to ask if you do not mind.
I was curious to know how you center yourself and clear your mind
prior to writing. I have had a tough time clearing my thoughts in getting my thoughts out.
I do take pleasure in writing but it just seems
like the first 10 to 15 minutes tend to be wasted simply
just trying to figure out how to begin. Any suggestions or hints?
Cheers!
Hey would you mind sharing which blog platform you’re using?
I’m looking to start my own blog in the near future but I’m having a difficult time making a decision between BlogEngine/Wordpress/B2evolution and Drupal.
The reason I ask is because your design and style seems different then most blogs and I’m looking for something unique.
P.S My apologies for getting off-topic but I had to ask!
Thanks for finally writing about > ER/ES実践講座(第10回)
製薬協EDC自主ガイダンスの考察(その1)
| お役立ち情報 < Loved it!
Great post.
Hi there, i read your blog from time to time and i own a similar one and i was just curious if you get a lot of spam comments?
If so how do you prevent it, any plugin or anything you
can recommend? I get so much lately it’s driving me insane so
any support is very much appreciated.
Thanks for finally writing about > ER/ES実践講座(第10回) 製薬協EDC自主ガイダンスの考察(その1) | お役立ち情報 < Liked it!
I don’t know if it’s just me or if perhaps everybody else experiencing problems with your site.
It appears as though some of the written text on your content are
running off the screen. Can someone else please comment and let me know if this is happening to them as well?
This might be a problem with my web browser because I’ve had this happen previously.
Many thanks
Hi there, every time i used to check web site posts here early in the break of day, as i enjoy to gain knowledge
of more and more.
I loved as much as you will receive carried out right here.
The sketch is attractive, your authored subject matter stylish.
nonetheless, you command get bought an impatience over that you wish be delivering the following.
unwell unquestionably come more formerly again as exactly the same nearly very often inside case you shield this hike.
Greetings from Ohio! I’m bored to death at work so I decided
to check out your site on my iphone during lunch break.
I enjoy the information you provide here and can’t wait
to take a look when I get home. I’m amazed at
how quick your blog loaded on my phone .. I’m not even using WIFI, just 3G ..
Anyhow, great site!
I love your blog.. very nice colors & theme.
Did you design this website yourself or did you hire someone to do it for
you? Plz reply as I’m looking to create my own blog and would like to find out where u
got this from. cheers
I will immediately clutch your rss as I can’t to find your email subscription link
or newsletter service. Do you’ve any? Please permit me know in order that I could subscribe.
Thanks.
http://pks-korea.com/bbs/board.php?bo_table=free&wr_id=840639
Its like you read my mind! You seem to know so
much about this, like you wrote the book in it or something.
I think that you can do with some pics to drive the message
home a bit, but other than that, this is magnificent blog.
An excellent read. I will definitely be back.
I am curious to find out what blog system you’re using? I’m having some small
security issues with my latest site and I would like to find
something more risk-free. Do you have any recommendations?
Hi, this weekend is fastidious for me, because this occasion i am reading this
great informative article here at my home.
Hey there! I understand this is sort of off-topic however I needed to ask.
Does operating a well-established blog such as yours take
a massive amount work? I’m completely new to blogging but I do write in my journal daily.
I’d like to start a blog so I can share my own experience and views online.
Please let me know if you have any recommendations or tips for new aspiring bloggers.
Thankyou!
Hey! I realize this is sort of off-topic but I needed to ask.
Does operating a well-established blog such as yours take a massive amount
work? I’m brand new to running a blog however I do write in my journal
on a daily basis. I’d like to start a blog so I can share my experience and
thoughts online. Please let me know if you have any
kind of suggestions or tips for new aspiring blog owners.
Thankyou!
Hi there, You have done a great job. I will certainly digg it and personally recommend to my
friends. I am sure they’ll be benefited from this website.
I’m not that much of a online reader to be honest but your sites really nice,
keep it up! I’ll go ahead and bookmark your site to come back later on. Many thanks
Hmm it appears like your blog ate my first comment (it was super long) so I guess I’ll just sum
it up what I submitted and say, I’m thoroughly enjoying your blog.
I as well am an aspiring blog blogger but I’m still new to the whole thing.
Do you have any suggestions for first-time blog writers?
I’d definitely appreciate it.
If you want to get a great deal from this piece of writing then you have to apply such techniques to
your won weblog.
I just couldn’t depart your web site before suggesting that I actually
enjoyed the usual information an individual provide on your visitors?
Is going to be back steadily to check up on new posts
What’s up to all, how is the whole thing, I think every
one is getting more from this web page, and your views are fastidious in favor of new visitors.
I have been exploring for a bit for any high-quality articles
or weblog posts on this sort of space . Exploring
in Yahoo I eventually stumbled upon this web site.
Reading this info So i am glad to show that I’ve a very excellent uncanny feeling I came upon just what I needed.
I so much no doubt will make certain to do not put out of your mind this site and provides it a
glance on a relentless basis.
Aw, this was an incredibly good post. Spending some time and actual
effort to generate a top notch article… but what can I say… I hesitate a lot and
don’t manage to get nearly anything done.
I am sure this piece of writing has touched all the internet viewers,
its really really fastidious piece of writing on building up new website.
Spot on with this write-up, I actually think this web site needs far more attention. I’ll probably
be returning to see more, thanks for the advice!
Hello, i believe that i saw you visited my website so i came to go back
the prefer?.I’m trying to to find issues to enhance my web site!I suppose its adequate to
make use of some of your ideas!!
What’s up friends, how is the whole thing, and what you want to say about this paragraph,
in my view its in fact amazing for me.
I simply could not depart your website prior to suggesting that I really
enjoyed the usual info a person supply on your guests?
Is gonna be again incessantly to check out new posts
Whats up very nice website!! Guy .. Beautiful ..
Superb .. I’ll bookmark your website and take the feeds additionally?
I’m happy to search out a lot of useful information here in the publish,
we want work out more strategies on this regard, thank you for sharing.
. . . . .
I would like to thank you for the efforts you have put
in writing this blog. I’m hoping to see the same high-grade
blog posts by you later on as well. In fact, your creative writing abilities has motivated me to get my very own blog now 😉
This is my first time visit at here and i am truly pleassant to read all at one place.
Hey I am so excited I found your web site, I really found you
by accident, while I was researching on Bing for something else, Nonetheless I am
here now and would just like to say many thanks for a tremendous post and a
all round exciting blog (I also love the theme/design),
I don’t have time to read it all at the moment but I have
bookmarked it and also added in your RSS feeds, so when I have time I
will be back to read much more, Please do keep up the fantastic job.
I’m not sure exactly why but this web site
is loading extremely slow for me. Is anyone else having
this problem or is it a problem on my end? I’ll check back later and see if the
problem still exists.
Hi, all is going fine here and ofcourse every one is sharing
information, that’s really excellent, keep up writing.
I could not refrain from commenting. Well written!
Aw, this was a really good post. Taking a few minutes and
actual effort to create a good article… but what
can I say… I put things off a lot and never seem to get anything done.
Great beat ! I wish to apprentice while you amend your web site, how can i subscribe for a
blog web site? The account helped me a acceptable deal.
I had been tiny bit acquainted of this your broadcast provided bright clear idea
What i do not realize is actually how you’re now not really much more neatly-preferred than you might be now.
You’re so intelligent. You recognize therefore significantly
on the subject of this topic, made me in my view consider it from numerous various
angles. Its like men and women are not involved unless
it’s something to accomplish with Lady gaga! Your individual stuffs outstanding.
All the time maintain it up!
Way cool! Some very valid points! I appreciate you penning
this write-up plus the rest of the site is very good.
Hi there it’s me, I am also visiting this website on a regular
basis, this web page is genuinely nice and the users are really sharing nice thoughts.
Great post however I was wanting to know if you could write a litte more
on this topic? I’d be very thankful if you could elaborate a little bit further.
Appreciate it!
Heya i am for the primary time here. I came across this board and I find It truly helpful & it helped me out much.
I am hoping to offer something again and help others like you aided
me.
Thanks very interesting blog!
Everything is very open with a clear description of the issues.
It was really informative. Your website is very useful. Thanks for
sharing!
Hi, i think that i saw you visited my web site so i came to “return the favor”.I’m attempting to find things to improve my web site!I suppose its
ok to use a few of your ideas!!
Great article.
Hello are using WordPress for your site platform? I’m new to the blog world but I’m trying to get started and set up my own. Do you need any html coding expertise to make your own blog?
Any help would be greatly appreciated!
Great blog! Is your theme custom made or did you download
it from somewhere? A design like yours with a few simple adjustements would really make my
blog shine. Please let me know where you got your design. Many thanks
This piece of writing offers clear idea for the new people of blogging, that
really how to do blogging.
Very energetic post, I liked that bit. Will there be a part 2?
I was able to find good advice from your content.
Heya! I’m at work surfing around your blog from my new iphone 3gs!
Just wanted to say I love reading through your blog and look forward to all
your posts! Carry on the excellent work!
Nice blog here! Also your site loads up very fast!
What host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as fast as yours lol
Hi, I log on to your new stuff daily. Your writing style is awesome, keep doing what you’re doing!
Hi, I log on to your blogs like every week.
Your story-telling style is witty, keep doing what you’re doing!
Amazing! This blog looks just like my old one! It’s on a completely different subject but it
has pretty much the same layout and design. Great choice of colors!
I’ll immediately seize your rss as I can’t to find your e-mail subscription hyperlink or newsletter service.
Do you have any? Kindly allow me know so that I may just subscribe.
Thanks.
Your mode of explaining everything in this piece of writing is in fact fastidious, all be capable of simply know it,
Thanks a lot.
Hi there, I check your blogs like every week.
Your writing style is awesome, keep up the good work!
Very soon this site will be famous amid all blog visitors, due to it’s good articles
Can I simply say what a comfort to find someone
that truly knows what they are discussing online. You definitely know how
to bring a problem to light and make it important. More and more people really need to check
this out and understand this side of the story. It’s surprising
you’re not more popular since you definitely possess the gift.
Spot on with this write-up, I actually believe
that this amazing site needs far more attention. I’ll probably be back again to read through more, thanks for
the information!
Ridiculous quest there. What happened after? Good luck!
magnificent post, very informative. I’m wondering why the other
experts of this sector don’t realize this. You must proceed your writing.
I’m confident, you’ve a great readers’ base already!
There is definately a great deal to learn about this topic.
I love all the points you’ve made.
Oh my goodness! Awesome article dude! Thank you, However I am going through
difficulties with your RSS. I don’t know why I am unable to join it.
Is there anyone else getting identical RSS issues?
Anyone that knows the solution will you kindly respond?
Thanks!!
Pretty element of content. I simply stumbled upon your site and
in accession capital to claim that I acquire actually
loved account your weblog posts. Anyway I’ll be subscribing on your augment and
even I success you get entry to persistently quickly.
Wow that was strange. I just wrote an very long comment but after I clicked submit my comment didn’t appear.
Grrrr… well I’m not writing all that over again.
Anyway, just wanted to say wonderful blog!
Its like you read my thoughts! You seem to understand a lot approximately this, like you wrote the ebook in it or something.
I think that you simply can do with some p.c. to drive
the message house a bit, but instead of that, that
is magnificent blog. A fantastic read. I’ll certainly be back.
My programmer is trying to convince me to move to .net from PHP.
I have always disliked the idea because of the expenses. But he’s
tryiong none the less. I’ve been using WordPress on various websites for about a
year and am concerned about switching to another platform.
I have heard very good things about blogengine.net.
Is there a way I can import all my wordpress posts into it?
Any help would be really appreciated!
For example, you may get $200 in bonus bets just for putting a $5
wager.
my web blog – 슈어맨
When the 2020 legislative session started, Gov.
Mills did indeed train her power to veto the Maine sports betting invoice.
Here is my site – get more info
By reaching out for help and support, individuals can take the first step toward overcoming their gambling-related
issues and regaining control of their lives.
Feel free to visit my web page :: website
Users have persistently reported positive experiences while utilizing the app.
My website :: check here
http://sstm.co.kr/bbs/board.php?bo_table=free&wr_id=19501
http://bohyeon.co.kr/bbs/board.php?bo_table=free&wr_id=97535
https://holderhernandez.livejournal.com/profile
Your post mentioned the importance of proper fixturing for reliable Hydraulic component specialists parts.
Do you have any advice or best practices for clamping complex-shaped workpieces
during machining?
Check out the CreditNinja Dojo for useful blogs wwith financial ideas and know-how.
My web-site: 급전 대출
Your monthly payments will vady depending on how a lot of your Credit Loan score you utilize.
Manage your accounts and playing cards, transfer cash, and
observe your monetary wellness.
Feel free to surf to my web blog … https://truevanities.com
FanDuel offers tons of betting markets, but by no means feels overwhelming.
my webpage; get more info
Our betting odds calculator is a superb device that may help present you how to calculate potential winnings.
my web page: 슈어맨
The staff has simce struggled too build a title-contending roster, however, largely as a result of poor management.
Review my homepage :: 슈어맨
See the sportsbook operator’s terms and situations for necessary particulars.
Also visit my web-site; get more info
Further, you’ll get a 10% crypto boost annd a 35% crypto bonus for subsequent
deposits.
Here is my web site … 슈어맨
Avoid putting all your eggs in a single basket, even for
matches that appear undeniably favourable.
Here is my site get more info
It’s a pity you don’t have a donate button! I’d most certainly donate to
this superb blog! I guess for now i’ll settle for book-marking and adding your RSS feed
to my Google account. I look forward to new
updates and will share this site with my Facebook group.
Chat soon!
We are a group of volunteers and opening a new scheme in our community.
Your website offered us with valuable information to work on. You’ve done an impressive job and our
whole community will be thankful to you.
Very nice post. I just stumbled upon your blog
and wished to say that I have truly enjoyed browsing your
blog posts. In any case I’ll be subscribing to your
feed and I hope you write again very soon!
I’ll right away clutch your rss feed as I can’t to find your email subscription hyperlink
or newsletter service. Do you have any? Kindly permit me understand so that I could subscribe.
Thanks.
What’s up friends, how is the whole thing, and what you desire to say on the topic of this article, in my
view its in fact awesome in favor of me.
You can definitely see your skills within the work you
write. The world hopes for even more passionate writers such as you who
are not afraid to say how they believe. Always go after your heart.
Thanks for your marvelous posting! I really enjoyed reading it, you might be a great
author.I will ensure that I bookmark your blog and may come
back in the foreseeable future. I want to encourage you to definitely continue your great work,
have a nice weekend!
I every time used to read piece of writing in news
papers but now as I am a user of web thus from now I am using net for content, thanks to web.
Howdy very cool blog!! Guy .. Beautiful .. Wonderful .. I’ll bookmark your website and take the feeds additionally?
I am happy to seek out so many useful info right here within the publish,
we need develop extra strategies on this regard, thanks for sharing.
. . . . .
https://cccmm47454.weeblysite.com/
I really like and appreciate your article post.Thanks Again. Cool.
Thanks-a-mundo for the blog.Thanks Again. Cool.
I think this is a real great blog. Keep writing.
I cannot thank you enough for the blog article. Will read on…
Fantastic post.Really thank you! Really Cool.
Great blog post.Really looking forward to read more. Fantastic.
Muchos Gracias for your blog.Really thank you! Really Great.
I appreciate you sharing this blog article. Much obliged.
Very informative article.Thanks Again. Really Cool.
Thanks for the post.Really looking forward to read more. Great.
I really liked your blog article.Much thanks again. Fantastic.
Great blog post.Really thank you! Awesome.
I appreciate you sharing this blog article.Much thanks again. Fantastic.
Awesome blog article.Thanks Again. Fantastic.
wow, awesome blog article.Really looking forward to read more. Really Great.
Really appreciate you sharing this blog post.Really looking forward to read more. Want more.
Really enjoyed this article.Really thank you! Will read on…
Hey, thanks for the article post.Much thanks again. Really Cool.
Thank you for your blog article. Want more.
Thanks-a-mundo for the blog article. Want more.
A big thank you for your blog article.Really thank you! Keep writing.
wow, awesome article post.Much thanks again.
I value the article.Really looking forward to read more. Really Cool.
Muchos Gracias for your blog.Really thank you! Keep writing.
Fantastic article post. Great.
A big thank you for your blog.Really looking forward to read more. Want more.
Muchos Gracias for your article post.Much thanks again. Really Great.
wow, awesome post.Much thanks again. Much obliged.
Thanks-a-mundo for the article post. Awesome.
Muchos Gracias for your blog.Really looking forward to read more. Much obliged.
https://ott-ip.com/search?type=shopping&sort=time_desc&keyword=병신
Major thankies for the article.Much thanks again. Cool.
I really enjoy the blog article.Much thanks again. Really Cool.
wow, awesome article post.Really thank you! Cool.
I really liked your blog post. Want more.
ivermectin shampoo ivermectin for scabies in humans
I really like and appreciate your blog article.Really looking forward to read more.
Im grateful for the article post.Really thank you! Much obliged.
I really enjoy the blog article.Really looking forward to read more. Keep writing.
Awesome blog.Much thanks again.
Película de Jim Bond en secuencia: ver 007, De Sean sean a Bennett en hebreo
This is one awesome post.Thanks Again. Cool.
Great blog post. Much obliged.
I am so grateful for your post.Really looking forward to read more. Really Cool.
We are looking for some people that are interested in from working their home on a full-time basis. If you want to earn $500 a day, and you don’t mind writing some short opinions up, this might be perfect opportunity for you!
Thanks so much for the post.Much thanks again. Cool.
Really enjoyed this post. Keep writing.
Great blog post.Really looking forward to read more. Great.
I really enjoy the blog.Really looking forward to read more. Awesome.
Muchos Gracias for your blog post.Thanks Again. Awesome.
I truly appreciate this blog post. Will read on…
Awesome blog.Really thank you! Will read on…
https://ott-ip.com/
Im thankful for the article.Much thanks again. Much obliged.
Hey, thanks for the blog. Awesome.
Thanks again for the post.Really looking forward to read more. Want more.
Thanks-a-mundo for the blog.Much thanks again. Awesome.
Muchos Gracias for your blog.Much thanks again. Cool.
Appreciate you sharing, great blog post.Really looking forward to read more.
Thanks-a-mundo for the blog article. Want more.
Muchos Gracias for your article.Really thank you! Want more.
Thanks for sharing, this is a fantastic blog post. Really Great.
Thanks-a-mundo for the article. Great.
Looking forward to reading more. Great blog post.Really looking forward to read more. Much obliged.
Appreciate you sharing, great blog article.Really looking forward to read more. Want more.
wow, awesome post.Really looking forward to read more. Want more.
Say, you got a nice blog.Really thank you! Really Cool.
Greetings! Very helpful advice in this particularpost! It is the little changes that will make the most significant changes.Many thanks for sharing!
Thanks again for the post.Really looking forward to read more. Awesome.
Awesome post.Much thanks again. Keep writing.
Thank you ever so for you article post. Will read on…
I cannot thank you enough for the blog.Much thanks again. Awesome.
Major thanks for the blog post.Much thanks again. Cool.
Hey, thanks for the blog post.Really thank you! Great.
I really like and appreciate your post.Really looking forward to read more. Much obliged.
Very neat article.Thanks Again. Want more.
Really informative post.Thanks Again. Really Cool.
Say, you got a nice article.Really thank you! Cool.
Im grateful for the blog article.Really thank you! Much obliged.
Thanks a lot for the article post. Great.
Thanks a lot for the post.Much thanks again. Fantastic.
A big thank you for your article.Really looking forward to read more. Much obliged.
Major thankies for the blog.
Appreciate you sharing, great article post.Really thank you! Want more.
Im grateful for the blog post.Really looking forward to read more. Really Cool.
I cannot thank you enough for the article post.Thanks Again. Keep writing.
I cannot thank you enough for the blog article.Thanks Again.
I really like and appreciate your blog.Really thank you! Fantastic.
Im grateful for the article post. Cool.
Major thanks for the post.Really thank you! Great.
Enjoyed every bit of your post. Really Great.
Major thankies for the blog article.Thanks Again. Really Cool.
I really like and appreciate your blog post. Much obliged.
I really enjoy the blog article.Much thanks again. Want more.
Enjoyed every bit of your blog.Really thank you! Awesome.
I value the blog post.Thanks Again. Will read on…
Very neat blog post.Really looking forward to read more. Keep writing.
Really appreciate you sharing this article.Thanks Again. Awesome.
I loved your blog post.Really thank you! Fantastic.
Really enjoyed this article.Much thanks again. Fantastic.
Im obliged for the article. Awesome.
I am so grateful for your article post. Keep writing.
Thanks for sharing, this is a fantastic post.Thanks Again. Will read on…
Appreciate you sharing, great post.Much thanks again. Awesome.
Major thankies for the blog post. Cool.
Very neat blog.Really thank you! Much obliged.
Very good blog post.Thanks Again. Fantastic.
Fantastic post. Much obliged.
This is one awesome article post.Really looking forward to read more. Really Great.
I cannot thank you enough for the post.Really thank you! Want more.
Fantastic blog.Really looking forward to read more. Keep writing.
I really enjoy the blog.Really thank you! Really Cool.
Appreciate you sharing, great blog.Really looking forward to read more. Great.
Thank you ever so for you post. Really Great.
Wow, great post.Much thanks again. Really Cool.
A round of applause for your article.
Appreciate you sharing, great post.Much thanks again. Cool.
Thanks-a-mundo for the blog post.
Great post.Really looking forward to read more. Really Cool.
Very neat article post.Much thanks again. Awesome.
Thanks for the article. Great.
Really informative article post.Really looking forward to read more. Really Great.
Thanks for the blog.Really looking forward to read more. Cool.
I appreciate you sharing this blog post.Really thank you! Will read on…
Major thanks for the blog article.Really looking forward to read more. Want more.
Great, thanks for sharing this article.Really thank you! Want more.
Im obliged for the blog post.Thanks Again. Keep writing.
Thanks for the article post.Thanks Again. Cool.
Thanks so much for the blog article.Thanks Again. Cool.
I think this is a real great article post.Really thank you! Fantastic.
Thanks-a-mundo for the post.Really thank you! Awesome.
Im obliged for the article.Much thanks again. Want more.
I really enjoy the blog post. Awesome.
Say, you got a nice post. Awesome.
Thanks again for the blog post.Really looking forward to read more. Want more.
Im obliged for the post. Will read on…
Hey, thanks for the article post.Much thanks again. Much obliged.
This is one awesome blog article. Great.
I am so grateful for your post.Really looking forward to read more. Will read on…
A round of applause for your article post.Much thanks again. Want more.
Very informative article post.Much thanks again. Really Cool.
Hey, thanks for the article post.Really thank you! Will read on…
Enjoyed every bit of your article post.Much thanks again. Awesome.
Very informative article post. Want more.
Very neat blog post.Thanks Again. Really Cool.
A big thank you for your blog article.Really looking forward to read more. Cool.
Say, you got a nice post.Thanks Again. Want more.
Major thanks for the post.Really thank you! Keep writing.
Major thanks for the blog.Really thank you! Great.
Thanks for the article.Much thanks again. Really Cool.
I truly appreciate this blog article.Really looking forward to read more. Really Great.
Really enjoyed this blog article. Cool.
Really appreciate you sharing this blog article.Much thanks again. Awesome.
I really liked your article.Really looking forward to read more. Cool.
Thanks a lot for the blog article.Much thanks again. Keep writing.
Looking forward to reading more. Great blog.Really looking forward to read more. Keep writing.
Thanks for sharing, this is a fantastic blog post.Really thank you! Really Great.
I think this is a real great post.Really looking forward to read more. Cool.
Fantastic post. Awesome.
Say, you got a nice blog post. Will read on…
Muchos Gracias for your blog post. Cool.
A round of applause for your blog.Really thank you! Want more.
I really liked your blog article.Really looking forward to read more. Awesome.
Thanks so much for the blog article.Much thanks again. Really Cool.
Thank you for your blog article.Really looking forward to read more.
I cannot thank you enough for the blog post.
Appreciate you sharing, great article.Much thanks again. Awesome.
A big thank you for your post.Really looking forward to read more. Much obliged.
Thanks again for the post.Really looking forward to read more. Want more.
Thank you ever so for you article. Want more.
wow, awesome blog. Will read on…
Fantastic blog article.Much thanks again. Want more.
Very neat article post.
I think this is a real great post.Thanks Again. Want more.
Say, you got a nice article post.Really thank you! Much obliged.
I value the article. Will read on…
Major thanks for the blog post.Really thank you!
A round of applause for your post.Really thank you! Cool.
Great, thanks for sharing this article.Thanks Again. Fantastic.
I appreciate you sharing this blog.
Im grateful for the article.Really thank you! Really Great.
Im obliged for the blog post.Really looking forward to read more. Much obliged.
I really like and appreciate your article post. Want more.
Great post.Really thank you! Want more.
Great article.Really looking forward to read more.
Thanks so much for the blog.Really thank you! Really Cool.
I value the blog post.Really thank you! Great.
Say, you got a nice article post. Much obliged.
I truly appreciate this blog article.Much thanks again. Cool.
I cannot thank you enough for the blog article.Thanks Again. Really Great.
Looking forward to reading more. Great article.Really thank you! Awesome.
I am so grateful for your article post. Really Great.
I appreciate you sharing this blog article.Really thank you! Cool.
Wow, great article post.Really looking forward to read more. Great.
Thank you ever so for you blog post.Really looking forward to read more. Want more.
I really like and appreciate your blog post.Really looking forward to read more. Awesome.
Major thanks for the article post.Really thank you! Great.
Looking forward to reading more. Great article post.Really thank you! Awesome.
I appreciate you sharing this article post.
A big thank you for your blog article. Really Great.
I value the blog.Really thank you! Keep writing.
Really enjoyed this blog article.Much thanks again. Cool.
I loved your blog post.Really thank you! Much obliged.
Really appreciate you sharing this post.Really thank you! Want more.
Really informative blog article.Much thanks again. Really Great.
Really appreciate you sharing this article post. Cool.
Enjoyed every bit of your article.Thanks Again. Really Cool.
Looking forward to reading more. Great blog.Much thanks again. Want more.
Major thankies for the article. Will read on…
Great, thanks for sharing this blog.Much thanks again. Cool.
Thank you for your article.Really looking forward to read more. Keep writing.
I appreciate you sharing this blog post.Much thanks again. Really Cool.
Hey, thanks for the article.Really thank you!
I loved your article.Really looking forward to read more. Keep writing.
Thank you ever so for you article.Really thank you! Much obliged.
Im obliged for the blog.Really looking forward to read more. Cool.
Thank you ever so for you post.Much thanks again. Great.
Thanks so much for the post.Thanks Again. Will read on…
Really informative blog.Really thank you! Really Great.
Thank you for your blog post.Thanks Again. Cool.
I think this is a real great blog post.Much thanks again. Want more.
I cannot thank you enough for the blog post.Much thanks again. Keep writing.
I truly appreciate this post.Much thanks again. Great.
I value the blog post.Really thank you! Keep writing.
Appreciate you sharing, great article post.Really thank you! Want more.
I value the blog article.Really looking forward to read more. Fantastic.
Major thankies for the blog article.Really looking forward to read more.
I cannot thank you enough for the blog post.Really looking forward to read more. Much obliged.
Very informative post.Really looking forward to read more. Will read on…
Looking forward to reading more. Great post.Much thanks again. Really Cool.
wow, awesome article post.Thanks Again. Keep writing.
Very informative blog article.Really looking forward to read more. Fantastic.
I really liked your blog.Really looking forward to read more. Really Cool.
A big thank you for your post. Awesome.
Major thankies for the article post.Really looking forward to read more. Want more.
wow, awesome blog article.Thanks Again. Cool.
This is one awesome article post.Really thank you! Cool.
Wow, great blog. Awesome.
Very good article post.Thanks Again. Really Cool.
Fantastic article post.Thanks Again. Cool.
Thanks again for the blog article.Really thank you! Much obliged.
Thanks again for the blog post. Cool.
A big thank you for your blog article.Really looking forward to read more. Really Cool.
I truly appreciate this article post.Much thanks again. Awesome.
Thanks for the blog post. Want more.
Enjoyed every bit of your article.Thanks Again. Keep writing.
Im thankful for the blog article.Really thank you! Much obliged.
I loved your blog post.Thanks Again. Will read on…
Im grateful for the article post.Thanks Again. Fantastic.
Thanks-a-mundo for the blog.Thanks Again. Much obliged.
I am so grateful for your post. Really Great.
Very neat article post.Really looking forward to read more. Keep writing.
Very good article.Thanks Again. Really Cool.
Very good article post. Fantastic.
Awesome post.Really thank you! Awesome.
Really informative blog post.Really thank you! Great.
Thank you ever so for you post.Really thank you! Great.
I am so grateful for your article post.Thanks Again. Want more.
Im obliged for the article post.Much thanks again.
Thanks a lot for the blog.Really thank you! Fantastic.
Major thanks for the post. Great.
I cannot thank you enough for the blog post.Really thank you!
A round of applause for your post.Really thank you! Will read on…
Enjoyed every bit of your post.Really thank you! Keep writing.
Very neat post.Much thanks again. Fantastic.
Very good post.Really looking forward to read more. Great.
Really enjoyed this article post.Thanks Again. Really Cool.
Muchos Gracias for your blog post.Really looking forward to read more. Cool.
Thanks so much for the blog.Really thank you! Keep writing.
I appreciate you sharing this article post.Really looking forward to read more. Keep writing.
Everything is very open with a really clear explanation of the issues. It was definitely informative. Your site is very helpful. Thank you for sharing.
May I simply just say what a relief to discover a person that genuinely knows what they’re talking about on the web. You definitely understand how to bring an issue to light and make it important. More people need to look at this and understand this side of the story. I was surprised you are not more popular because you definitely have the gift.
I used to be able to find good advice from your articles.
I love it when people get together and share thoughts. Great website, stick with it.
After checking out a number of the articles on your blog, I seriously like your technique of blogging. I bookmarked it to my bookmark site list and will be checking back in the near future. Please visit my web site as well and tell me what you think.
Facebook Chat Assistant – $30/hr ! Do you use Facebook? Are you looking for a job you can do online? Hundreds of businesses are currently hiring new Facebook Chat Assistants to chat with their customers on Facebook. There are a lot of positions available for people from all countries and because of the high demand for new workers, entry level jobs are paying $30/hr. If that sounds like something you’re interested in, read on for the full job spec here : http://chat-assistant.advertising4you.co.uk
Everything is very open with a precise clarification of the issues. It was really informative. Your website is extremely helpful. Thank you for sharing!
Way cool! Some very valid points! I appreciate you penning this write-up plus the rest of the site is also really good.
You need to take part in a contest for one of the best sites on the net. I am going to recommend this website!
Excellent post. I absolutely appreciate this site. Stick with it!
I was able to find good info from your blog articles.
I’m very pleased to uncover this website. I want to to thank you for your time just for this wonderful read!! I definitely loved every part of it and i also have you book marked to look at new information on your website.
Very nice blog post. I definitely appreciate this website. Keep writing!
I wanted to thank you for this very good read!! I absolutely enjoyed every bit of it. I’ve got you book marked to look at new things you post…
Greetings! Very helpful advice within this post! It’s the little changes that will make the most significant changes. Thanks a lot for sharing!
Hi there! I just wish to offer you a big thumbs up for the excellent information you have got here on this post. I’ll be returning to your website for more soon.
Great article. I’m dealing with many of these issues as well..
An outstanding share! I have just forwarded this onto a friend who has been doing a little research on this. And he actually ordered me lunch due to the fact that I found it for him… lol. So let me reword this…. Thanks for the meal!! But yeah, thanks for spending time to talk about this issue here on your web page.
I’m amazed, I have to admit. Seldom do I encounter a blog that’s both equally educative and interesting, and let me tell you, you’ve hit the nail on the head. The problem is something not enough people are speaking intelligently about. I’m very happy that I came across this in my hunt for something concerning this.
You made some really good points there. I looked on the web for additional information about the issue and found most individuals will go along with your views on this web site.
There is definately a great deal to know about this subject. I love all of the points you made.
This site truly has all the information I wanted concerning this subject and didn’t know who to ask.
Everyone loves it when people come together and share views. Great blog, keep it up!
Hello there! I could have sworn I’ve visited your blog before but after going through many of the posts I realized it’s new to me. Nonetheless, I’m certainly happy I discovered it and I’ll be book-marking it and checking back regularly.
You are so cool! I don’t believe I’ve read through a single thing like this before. So great to find another person with unique thoughts on this topic. Seriously.. many thanks for starting this up. This web site is something that is required on the internet, someone with a little originality.
Having read this I thought it was extremely enlightening. I appreciate you finding the time and effort to put this information together. I once again find myself spending way too much time both reading and leaving comments. But so what, it was still worth it.
This website was… how do you say it? Relevant!! Finally I’ve found something that helped me. Thank you!
I value the post.Much thanks again.
You should be a part of a contest for one of the best sites on the internet. I most certainly will recommend this web site!
Everything is very open with a precise explanation of the challenges. It was truly informative. Your site is useful. Thank you for sharing!
This is a topic that’s near to my heart… Cheers! Exactly where can I find the contact details for questions?
This site definitely has all the information and facts I needed about this subject and didn’t know who to ask.
You need to take part in a contest for one of the greatest blogs online. I will highly recommend this blog!
Saved as a favorite, I like your website.
An interesting discussion is definitely worth comment. I do think that you should write more about this topic, it might not be a taboo matter but generally folks don’t speak about such issues. To the next! Best wishes!
Great post! We will be linking to this great content on our site. Keep up the great writing.
This website definitely has all the info I wanted concerning this subject and didn’t know who to ask.
Your style is very unique compared to other people I’ve read stuff from. Thanks for posting when you have the opportunity, Guess I’ll just bookmark this page.
Everything is very open with a precise clarification of the issues. It was definitely informative. Your website is very helpful. Thanks for sharing!
Way cool! Some extremely valid points! I appreciate you writing this write-up plus the rest of the site is very good.
Way cool! Some extremely valid points! I appreciate you penning this article plus the rest of the site is extremely good.
Very nice blog post. I certainly love this site. Thanks!
After I initially commented I seem to have clicked on the -Notify me when new comments are added- checkbox and from now on whenever a comment is added I receive 4 emails with the exact same comment. Is there a means you can remove me from that service? Kudos.
sapphire clinic
doktor kbb
dr güncel
dr kandulu
hairneva
dr şaban
Everyone loves it whenever people get together and share opinions. Great blog, keep it up.
It’s nearly impossible to find experienced people about this topic, but you sound like you know what you’re talking about! Thanks
Very good post! We are linking to this particularly great article on our website. Keep up the great writing.
Spot on with this write-up, I really believe that this website needs much more attention. I’ll probably be returning to read more, thanks for the info!
Next time I read a blog, I hope that it doesn’t fail me just as much as this one. After all, I know it was my choice to read through, however I really believed you would have something useful to talk about. All I hear is a bunch of whining about something you could fix if you weren’t too busy seeking attention.
I must thank you for the efforts you have put in penning this website. I really hope to check out the same high-grade content from you in the future as well. In truth, your creative writing abilities has encouraged me to get my own, personal site now 😉
smile
dr terziler
When I originally commented I seem to have clicked on the -Notify me when new comments are added- checkbox and from now on each time a comment is added I recieve 4 emails with the same comment. Perhaps there is a way you can remove me from that service? Appreciate it.
esteworld
You are so cool! I don’t think I have read anything like this before. So nice to find another person with genuine thoughts on this subject matter. Seriously.. thanks for starting this up. This web site is one thing that’s needed on the internet, someone with a bit of originality.
medhair
sapphire hair clinic
I loved your post. Really Great.
Great info. Lucky me I came across your site by accident (stumbleupon). I’ve book marked it for later.
Howdy, I do believe your blog could possibly be having web browser compatibility issues. When I take a look at your web site in Safari, it looks fine however, when opening in Internet Explorer, it’s got some overlapping issues. I simply wanted to give you a quick heads up! Other than that, excellent blog!
Greetings! Very useful advice within this article! It is the little changes that will make the largest changes. Many thanks for sharing!
You’ve made some really good points there. I looked on the net for more info about the issue and found most individuals will go along with your views on this web site.
Hi there! I could have sworn I’ve visited this website before but after looking at many of the articles I realized it’s new to me. Anyways, I’m definitely pleased I stumbled upon it and I’ll be bookmarking it and checking back often!
Hello there! This article couldn’t be written any better! Looking at this post reminds me of my previous roommate! He always kept talking about this. I will send this article to him. Pretty sure he’s going to have a good read. I appreciate you for sharing!
Can I just say what a comfort to uncover a person that genuinely understands what they’re discussing on the internet. You certainly know how to bring an issue to light and make it important. More and more people need to read this and understand this side of the story. I can’t believe you aren’t more popular since you definitely have the gift.
When I initially left a comment I seem to have clicked the -Notify me when new comments are added- checkbox and from now on each time a comment is added I get four emails with the same comment. There has to be a way you are able to remove me from that service? Cheers.
This is the right web site for anyone who wants to find out about this topic. You understand a whole lot its almost tough to argue with you (not that I personally would want to…HaHa). You definitely put a new spin on a subject which has been discussed for a long time. Great stuff, just wonderful.
You ought to take part in a contest for one of the best sites online. I most certainly will highly recommend this website!
Very good post! We are linking to this particularly great post on our site. Keep up the good writing.
This is a topic that’s near to my heart… Take care! Where can I find the contact details for questions?
Good post! We will be linking to this great post on our website. Keep up the great writing.
Your style is really unique in comparison to other folks I’ve read stuff from. I appreciate you for posting when you’ve got the opportunity, Guess I’ll just book mark this blog.
When I originally commented I seem to have clicked the -Notify me when new comments are added- checkbox and now whenever a comment is added I get 4 emails with the same comment. Perhaps there is an easy method you are able to remove me from that service? Thanks.
Fantastic blog.Really thank you! Really Great.
Im thankful for the blog post. Cool.
This website was… how do I say it? Relevant!! Finally I have found something which helped me. Kudos.
I love it when individuals get together and share ideas. Great website, stick with it!
Everything is very open with a really clear explanation of the issues. It was really informative. Your site is extremely helpful. Thank you for sharing.
Thanks for sharing, this is a fantastic article.Really thank you! Fantastic.
The very next time I read a blog, I hope that it doesn’t fail me just as much as this one. After all, Yes, it was my choice to read, nonetheless I really thought you would have something useful to talk about. All I hear is a bunch of whining about something that you could fix if you were not too busy seeking attention.
After looking into a number of the blog posts on your site, I honestly like your way of blogging. I bookmarked it to my bookmark website list and will be checking back in the near future. Please check out my web site as well and let me know how you feel.
The next time I read a blog, I hope that it doesn’t disappoint me just as much as this particular one. I mean, Yes, it was my choice to read, however I really believed you would have something helpful to talk about. All I hear is a bunch of whining about something you could fix if you weren’t too busy searching for attention.
Hello there, I do think your site could possibly be having internet browser compatibility issues. When I take a look at your site in Safari, it looks fine however, if opening in Internet Explorer, it has some overlapping issues. I just wanted to give you a quick heads up! Aside from that, wonderful site!
This site certainly has all the information and facts I wanted concerning this subject and didn’t know who to ask.
Everything is very open with a really clear explanation of the challenges. It was definitely informative. Your site is very useful. Thanks for sharing!
Very good article. I certainly love this site. Keep writing!
Excellent post! We will be linking to this particularly great content on our site. Keep up the great writing.
After looking into a handful of the articles on your web page, I truly like your way of blogging. I saved as a favorite it to my bookmark website list and will be checking back in the near future. Please check out my website too and tell me your opinion.
This blog was… how do you say it? Relevant!! Finally I’ve found something that helped me. Appreciate it!
I blog often and I truly appreciate your content. The article has really peaked my interest. I will book mark your website and keep checking for new information about once per week. I opted in for your RSS feed too.
This is a very good tip particularly to those fresh to the blogosphere. Short but very accurate information… Appreciate your sharing this one. A must read post!
An impressive share! I have just forwarded this onto a colleague who was doing a little homework on this. And he in fact bought me lunch simply because I discovered it for him… lol. So allow me to reword this…. Thanks for the meal!! But yeah, thanks for spending some time to talk about this topic here on your internet site.
I like looking through a post that will make men and women think. Also, thank you for allowing for me to comment.
Die Qualität der Online-Casinospiele im RoyalGame Casino wird maßgeblich von den 100+ Softwareanbietern bestimmt, die die Spiele bereitstellen. Sie erhalten vom Online Casino insgesamt bis zu 3.000 €, 200 Freispiele und eine Bonuskrabbe. Besonders vielversprechend erscheint das Willkommenspaket, welches sich über vier Einzahlungsboni erstreckt. Was RoyalGame besonders auszeichnet, ist die benutzerfreundliche Plattform, die sowohl für Anfänger als auch erfahrene Spieler eine nahtlose Erfahrung bietet.
Im Allgemeinen handelt es sich hier um ein gutes Casino, in dem man durchaus spielen kann, aber es gibt einige Dinge, die es zu beachten gilt. RoyalGame ist ein gut reguliertes und lizenziertes Online Casino, das eine breite Auswahl an Spielen wie Online-Spielautomaten, Tischspiele und Live-Casino-Optionen bietet. Vor der ersten Auszahlung werden Sie zudem zu einer Identitätsprüfung aufgefordert, die sicherstellt, dass nur volljährige Personen spielen können. Um die Umsatzbedingungen zu erfüllen und das Bonusguthaben zufreizuspielen, müssen Sie den Bonus plus Einzahlung 35 Mal und die Gewinne aus den Freispielen 40 Mal umsetzen. Die intuitive Navigation und das moderne Design sorgen dafür, dass Sie schnell zu Ihren Lieblingsspielen gelangen.
References:
https://online-spielhallen.de/venlo-casino-aktionscode-ihre-chance-auf-mehr-spielspas/
Wenn Sie ein kostenloses Spiel laden, erhalten Sie einen bestimmten Betrag in einer virtuellen Währung, die keinen realen Wert hat. Kostenlose Casinospiele sind eine ausgezeichnete (und vor allem sichere) Möglichkeit, neue oder unbekannte Spiele auszuprobieren und dabei ein bisschen Spaß zu haben, ohne den Druck zu fühlen, eventuell Geld zu verlieren. In der weiten Welt der Casinospiele gibt es eine große und umfangreiche Auswahl an verschiedenen Spielthemen zum Ausprobieren. Crash Games sind eine Art Glücksspiel, das häufig in Krypto Casinos zu finden ist.
Die Casino Spiele die kostenlos sind, sind nämlich auch für mobile Endgeräte optimiert. Nicht selten sind auch die besten Spieler bei einer Anmeldung in einem neuen Online Casino genervt, weil sie sich erst mal mit dem Design und den Spielabläufen zurechtfinden müssen. Eines der beliebtesten Spiele im Casino, Blackjack, lädt zum gratis Spiel ein. Aber auch beim Roulette und Baccarat kann man durch gratis Casino Spiele lernen, wie man den Hausvorteil minimiert und seine Bankroll organisiert.
References:
https://online-spielhallen.de/500-casino-freispiele-ihr-weg-zu-extra-spielspas/
Doch wichtig ist natürlich auch, was online casino Österreich Echtgeld sonst noch zu bieten haben. Die erfolgreichsten Livecasinos bieten unter anderem die Vielfalt an Tischspielen wie Fußball Studios und Dream Catcher. Auch online casino Österreich legal Echtgeld sind nur wenige Casinos Teil des Glücksspiel-Monopols.
Dazu können Sie beim Autospiel Limits einstellen und insgesamt mit gerade mal 10 Cent pro Dreh spielen. Ein Wunderschönes noch dazu, mit einer netten Bonus-Funktion und knackigen Freispielen. Die Mystery Reveal Funktion kommt dabei sowohl im Basis-Spiel als auch in den Freispielen vor. Die Hexen-Brut verhilft Ihnen gerne zu höheren Gewinnen, gerade in den Freispielen.
References:
https://online-spielhallen.de/monro-casino-test-erfahrungen-fur-deutsche-spieler/
I was excited to find this website. I wanted to thank you for your time for this wonderful read!! I definitely savored every bit of it and i also have you bookmarked to check out new things on your site.
Spot on with this write-up, I honestly feel this site needs a great deal more attention. I’ll probably be back again to read more, thanks for the info!
This blog was… how do I say it? Relevant!! Finally I’ve found something which helped me. Thank you.
This excellent website really has all the information I wanted about this subject and didn’t know who to ask.
Your style is unique in comparison to other folks I have read stuff from. I appreciate you for posting when you have the opportunity, Guess I’ll just book mark this site.
Thanks again for the article.Much thanks again. Really Cool.
Hi there! This blog post could not be written any better! Going through this post reminds me of my previous roommate! He always kept talking about this. I most certainly will forward this post to him. Fairly certain he’s going to have a good read. Thank you for sharing!
Pretty! This has been an incredibly wonderful post. Many thanks for providing this info.
Very good blog article.Thanks Again. Great.
Greetings! Very useful advice in this particular article! It’s the little changes that will make the most significant changes. Thanks for sharing!
Awesome blog post.Much thanks again. Really Cool.
Major thankies for the blog article.Thanks Again. Much obliged.
Im obliged for the post.Thanks Again. Great.
Fantastic blog article.Really looking forward to read more. Awesome.
After checking out a few of the blog articles on your web page, I really like your technique of writing a blog. I book marked it to my bookmark site list and will be checking back in the near future. Please visit my web site too and tell me how you feel.
Fantastic article post. Keep writing.
This website certainly has all of the info I wanted concerning this subject and didn’t know who to ask.
Good post. I learn something new and challenging on sites I stumbleupon everyday. It will always be helpful to read through articles from other authors and practice a little something from their web sites.
Very nice write-up. I certainly love this site. Continue the good work!
Oh my goodness! Amazing article dude! Many thanks, However I am going through issues with your RSS. I don’t know why I am unable to join it. Is there anyone else having identical RSS issues? Anybody who knows the answer can you kindly respond? Thanks.
Can I simply say what a relief to discover someone that truly understands what they’re discussing online. You definitely know how to bring an issue to light and make it important. A lot more people ought to read this and understand this side of the story. I can’t believe you aren’t more popular since you certainly possess the gift.
Can I simply say what a relief to uncover an individual who really knows what they’re talking about on the web. You definitely know how to bring an issue to light and make it important. A lot more people ought to read this and understand this side of your story. I was surprised you are not more popular since you definitely possess the gift.
Your style is so unique compared to other people I have read stuff from. Thank you for posting when you’ve got the opportunity, Guess I will just book mark this page.
Your style is unique compared to other folks I’ve read stuff from. Thanks for posting when you have the opportunity, Guess I will just book mark this web site.
Sharing is encouraged (but no judgment if you’re steaking your claim on the last bite). Spread across multiple dining areas, it’s got room for you, your crew and all the indulgence your heart desires. When the urge for a next level steak won’t quit, sometimes you just have to leave it in the hands of the pros. There are not many dishes that compare to the satisfaction of a succulent steak cooked to perfection, though there is often a lot more to the art of this dish than meats the eye.
Our live table games selection includes blackjack, baccarat, roulette, sic bo, and more — all hosted by experienced dealers in an elegant setting. The Star Gold Coast is more than a casino – it’s a destination for luxury, excitement, and unforgettable experiences. Enjoy your favourite pokies, classic table games, and live dealers — anytime, anywhere. A fine dining style steakhouse, though the more upscale take will come as a surprise to absolutely no one given it’s situated within the swanky Sanctuary Cove dining precinct #ohshefancyhuh. This coastal hotspot serves up a high-steaks dining experience that’s worth every bite. Holy ShipLet’s not do things in halves; why not hop aboard a real-life fishing trawler (cleaned and manicured) for your next seafood dining experience?
Relax in five-star suites, unwind at the spa, or take in ocean views — all part of The Star experience. Nestled on Australia’s stunning Gold Coast, this iconic resort now brings the thrill of the casino floor to your fingertips with The Star Gold Coast Casino Online. Dive into the world the authentic Vegas thrills anytime, anywhere!
References:
https://blackcoin.co/15-top-uk-no-wagering-no-deposit-casinos-you-shall-try-this-year/
This is the right website for anyone who hopes to understand this topic. You know so much its almost hard to argue with you (not that I actually will need to…HaHa). You definitely put a new spin on a topic that has been discussed for years. Excellent stuff, just wonderful.
High chance of showers. Information supplied by Weatherzone based on data provided by the Bureau of Meteorology (BOM) Medium chance of showers in the N, slight chance elsewhere. Personalise your weather experience and unlock powerful new features. Temperature hovers around 28°c and at night it feels like 19°c. If you would just like to know what the weather was for a past dates for research or education or you are just curious then visit our historical weather of Casino section.
Showers late at night. Afternoon showers. NNW winds shifting to E at 15 to 25 km/h. Partly cloudy. Skies clearing late.
References:
https://blackcoin.co/play-at-wild-fortune-online-casino/
Many of the best online casinos in Australia are international platforms that support AUD and have special content for OZ pokie lovers. Auspokies experts have carefully curated this selection of the best online casino clubs to provide our readers with renowned iGaming options. To ensure a https://blackcoin.co/comprehensive-guide-to-online-casino-play/ experience, always choose licensed casinos, use secure payment methods, and take advantage of responsible gambling tools. The best online casinos in Australia for 2025 include Neospin, Dundeeslots, 1Red Casino, Queenspins, and others.
The catalogue has only a couple of hundred titles, which is unusual given the enormous libraries at other top online casinos in Australia. One of the best online casinos in Australia also suggests similar titles that gamblers might enjoy. People can add money to their accounts via top online casino methods or choose from several crypto options, with the latter having higher cashout ceilings. However, our experts have made a shortlist of the top 10 online casinos in Australia that boast a stellar reputation among gamblers.
In summary, the best online casinos in Australia for 2025 offer a diverse and exciting array of options for players. The best online casinos prioritize high-quality games from renowned providers, ensuring a premium gaming experience. Australian online casinos offer a diverse range of games to cater to various player preferences. The competition among these top Australian online casinos ensures that players have access to innovative gaming experiences and generous rewards throughout 2025.
Everything is very open with a precise explanation of the challenges. It was really informative. Your site is useful. Thanks for sharing!
The very next time I read a blog, Hopefully it won’t fail me just as much as this particular one. I mean, I know it was my choice to read through, however I truly believed you’d have something helpful to say. All I hear is a bunch of whining about something that you could fix if you weren’t too busy looking for attention.
Hi, I do think this is an excellent site. I stumbledupon it 😉 I may come back yet again since i have saved as a favorite it. Money and freedom is the best way to change, may you be rich and continue to guide others.
Excellent web site you have got here.. It’s hard to find quality writing like yours nowadays. I seriously appreciate people like you! Take care!!
It’s simple to treat yourself to nine wonderful eateries and hotel accommodations. Whether you decide to stay at the Motor Inn or in the Tower Premier Suite, you’ll find that your hotel accommodations at Wrest Point are some of the best around. Located in Sandy Bay, this luxury hotel is within 2 mi (3 km) of Salamanca Place, Salamanca Market, and Constitution Dock. For those seeking proximity to the water, the Water Edge rooms provide serene river views, while the Motor Inn rooms offer comfortable and affordable options with easy access to the resort’s facilities. Wrest Point’s location, stunning views and spaces that include foyers, restaurants, bars, and large and small private rooms ensure every occasion will impress.
Hobart is home to a significant number of nationally known restaurants, boutique alcohol producers, including Sullivans Cove Whiskey, which won world’s best single malt in 2014, boutique hotels, and art experiences. The city is a popular cruise ship destination during the summer months, with 47 such ships docking during the course of the 2016–17 summer season, and $34.5 million in direct expenditure in 2017 (an average spend of $172 per passenger). In 2021, Greater Hobart’s main occupations were professionals and service workers, trades, administration and management and other labour professions working in industries such as healthcare, the public service, and supermarkets and small businesses. Hobart has a Baháʼí community, with a Baháʼí Centre of Learning, located within the city. Hobart has a small community of 456 members of the Church of Jesus Christ of Latter-day Saints, with meetinghouses in Glenorchy, Rosny, and Glen Huon. At the 2016 census, The most common occupation categories were professionals (22.6%), clerical and administrative workers (14.7%), technicians and trades workers (13.3%), community and personal service workers (12.8%), and managers (11.3%).
You can also try Federal Pontoon, a variation of conventional Blackjack which provides a better opportunity to pocket bonus payouts and win big. Starting every day from 2pm, up until very late hours of the day, players have the opportunity to enjoy various table games, pokies, and cash poker. Aside from the exceptionally comfortable gaming, you can enjoy a wonderful buffet or dinner with a view at their revolving restaurant. Plus, there’s a fine range of choices regarding accommodations, restaurants, bars, and entertainment. Free WiFi in public areas and free self parking are also provided.
References:
https://blackcoin.co/comprehensive-guide-to-online-casino-play/
Great info. Lucky me I came across your website by accident (stumbleupon). I have saved it for later!
I used to be able to find good advice from your blog posts.
You’ve made some decent points there. I checked on the internet to find out more about the issue and found most people will go along with your views on this web site.
Oh my goodness! Impressive article dude! Many thanks, However I am experiencing issues with your RSS. I don’t know why I can’t join it. Is there anyone else having the same RSS issues? Anyone that knows the solution will you kindly respond? Thanx!
Nice post. I learn something new and challenging on blogs I stumbleupon every day. It will always be useful to read articles from other authors and practice a little something from their websites.
You are so interesting! I don’t think I’ve read through something like this before. So nice to discover another person with genuine thoughts on this subject matter. Seriously.. many thanks for starting this up. This website is one thing that’s needed on the internet, someone with some originality.
Hello, I believe your site could be having web browser compatibility issues. Whenever I take a look at your blog in Safari, it looks fine however when opening in I.E., it has some overlapping issues. I just wanted to provide you with a quick heads up! Other than that, great site.
This website was… how do you say it? Relevant!! Finally I have found something which helped me. Thanks a lot.
I would like to thank you for the efforts you’ve put in penning this website. I’m hoping to see the same high-grade blog posts from you later on as well. In fact, your creative writing abilities has motivated me to get my very own blog now 😉
casino with paypal
References:
https://jobsinodisha.org/companies/paypal-casinos-in-australia-2025-top-online-casinos-accepting-paypal-onlinecasinopulse/
paypal casino online
References:
https://www.thedreammate.com/home/bbs/board.php?bo_table=free&wr_id=5173262
casino con paypal
References:
https://www.jobassembly.com/companies/beste-paypal-casinos-in-deutschland-2025/
paypal online casinos
References:
https://acheemprego.com.br/employer/best-paypal-casinos-updated-2025/
online casino uk paypal
References:
http://damoa8949.com/bbs/board.php?bo_table=free&wr_id=848
online pokies paypal
References:
http://www.maridin.tr/profile/tristan864442
usa casino online paypal
References:
https://www.makemyjobs.in/companies/10-best-online-casinos-in-australia-for-real-money-in-2025/
paypal casinos online that accept
References:
https://jobs.unigotravels.com/employer/best-new-online-casinos-australia-2025-recently-launched/
Hey there! I simply would like to offer you a huge thumbs up for your excellent information you have got here on this post. I’ll be coming back to your site for more soon.
Very good post! We are linking to this great post on our website. Keep up the good writing.
I was pretty pleased to discover this great site. I wanted to thank you for ones time due to this wonderful read!! I definitely appreciated every part of it and I have you bookmarked to see new things on your blog.
bookmarked!!, I like your site.
After I originally commented I seem to have clicked on the -Notify me when new comments are added- checkbox and now whenever a comment is added I receive four emails with the same comment. There has to be a means you can remove me from that service? Cheers.
You should take part in a contest for one of the best sites on the net. I’m going to recommend this web site!
This is a topic that’s near to my heart… Take care! Exactly where are your contact details though?
I like reading through an article that can make people think. Also, thank you for permitting me to comment.
Oh my goodness! Amazing article dude! Thank you so much, However I am experiencing problems with your RSS. I don’t understand the reason why I can’t join it. Is there anyone else getting the same RSS problems? Anyone that knows the answer can you kindly respond? Thanks!
You are so awesome! I don’t suppose I’ve truly read through anything like that before. So great to find someone with some genuine thoughts on this subject. Really.. many thanks for starting this up. This web site is one thing that’s needed on the internet, someone with some originality.
Good info. Lucky me I ran across your blog by accident (stumbleupon). I have saved as a favorite for later.
This is a very good tip especially to those new to the blogosphere. Short but very accurate information… Appreciate your sharing this one. A must read post!
You ought to be a part of a contest for one of the most useful websites on the internet. I will recommend this site!
It’s hard to come by educated people about this topic, however, you seem like you know what you’re talking about! Thanks
Hey there! I just wish to give you a huge thumbs up for your great information you have right here on this post. I am returning to your blog for more soon.
Everyone loves it when folks get together and share views. Great blog, stick with it.
Saved as a favorite, I love your site.
An impressive share! I have just forwarded this onto a coworker who had been conducting a little homework on this. And he in fact bought me dinner because I stumbled upon it for him… lol. So let me reword this…. Thanks for the meal!! But yeah, thanx for spending the time to discuss this subject here on your blog.
Pretty! This has been a really wonderful article. Thank you for supplying this info.
I was able to find good information from your blog articles.
bookmarked!!, I like your site!
Hi, I do believe this is an excellent blog. I stumbledupon it 😉 I will come back yet again since I book marked it. Money and freedom is the greatest way to change, may you be rich and continue to guide others.
May I simply say what a relief to find somebody that actually understands what they’re discussing on the web. You certainly realize how to bring an issue to light and make it important. A lot more people should check this out and understand this side of your story. I was surprised you aren’t more popular because you surely have the gift.
After going over a handful of the blog articles on your site, I truly appreciate your technique of writing a blog. I added it to my bookmark webpage list and will be checking back soon. Please check out my website as well and tell me what you think.
This is a topic that’s close to my heart… Many thanks! Exactly where are your contact details though?
Pretty! This has been an incredibly wonderful article. Many thanks for supplying this information.
Hello there! I could have sworn I’ve visited this web site before but after going through many of the articles I realized it’s new to me. Nonetheless, I’m definitely pleased I discovered it and I’ll be bookmarking it and checking back regularly.
This web site truly has all the information and facts I needed about this subject and didn’t know who to ask.
Hello, I think your website could be having web browser compatibility issues. Whenever I take a look at your web site in Safari, it looks fine but when opening in Internet Explorer, it’s got some overlapping issues. I simply wanted to provide you with a quick heads up! Apart from that, wonderful website.
Hi! I could have sworn I’ve visited this web site before but after looking at some of the posts I realized it’s new to me. Anyways, I’m certainly happy I discovered it and I’ll be book-marking it and checking back often.
I couldn’t resist commenting. Perfectly written.
This web site certainly has all of the information and facts I wanted about this subject and didn’t know who to ask.
Can I just say what a relief to uncover someone that truly understands what they’re discussing on the net. You definitely understand how to bring an issue to light and make it important. More and more people must look at this and understand this side of your story. I was surprised that you’re not more popular because you certainly possess the gift.
I’m more than happy to discover this web site. I need to to thank you for your time for this fantastic read!! I definitely liked every part of it and i also have you bookmarked to see new information in your site.
Visit My website – I appreciate all the effort you put into this.
This website certainly has all the information and facts I wanted concerning this subject and didn’t know who to ask.
Everyone loves it when folks come together and share thoughts. Great website, continue the good work!
I need to to thank you for this great read!! I certainly loved every bit of it. I have got you book-marked to look at new things you post…
I’m impressed, I must say. Rarely do I come across a blog that’s equally educative and entertaining, and let me tell you, you have hit the nail on the head. The issue is something not enough people are speaking intelligently about. Now i’m very happy I stumbled across this during my hunt for something relating to this.
You’ve made some decent points there. I looked on the web for more info about the issue and found most individuals will go along with your views on this web site.
Wonderful post! We will be linking to this particularly great post on our website. Keep up the great writing.
Hi! I could have sworn I’ve been to this site before but after going through a few of the articles I realized it’s new to me. Regardless, I’m definitely delighted I found it and I’ll be book-marking it and checking back frequently.
Hi! I could have sworn I’ve been to this blog before but after looking at many of the articles I realized it’s new to me. Anyhow, I’m definitely delighted I came across it and I’ll be bookmarking it and checking back regularly.
I have to thank you for the efforts you have put in penning this site. I really hope to view the same high-grade blog posts from you in the future as well. In fact, your creative writing abilities has inspired me to get my very own website now 😉
Pretty! This has been an extremely wonderful post. Thank you for providing these details.
I must thank you for the efforts you have put in writing this blog. I am hoping to check out the same high-grade blog posts by you later on as well. In truth, your creative writing abilities has motivated me to get my own blog now 😉
Excellent site you’ve got here.. It’s difficult to find excellent writing like yours nowadays. I seriously appreciate individuals like you! Take care!!
Having read this I thought it was really enlightening. I appreciate you finding the time and energy to put this short article together. I once again find myself personally spending a significant amount of time both reading and posting comments. But so what, it was still worth it!
Very good info. Lucky me I recently found your site by chance (stumbleupon). I’ve bookmarked it for later.
An interesting discussion is worth comment. There’s no doubt that that you need to write more on this subject matter, it may not be a taboo subject but generally folks don’t speak about such topics. To the next! All the best.
I was excited to find this page. I wanted to thank you for your time due to this wonderful read!! I definitely really liked every part of it and I have you book marked to look at new things in your web site.
Good day! I just wish to offer you a huge thumbs up for your excellent info you have got right here on this post. I am returning to your site for more soon.
I blog frequently and I truly thank you for your information. Your article has truly peaked my interest. I’m going to take a note of your site and keep checking for new information about once a week. I subscribed to your RSS feed too.
After I originally left a comment I seem to have clicked on the -Notify me when new comments are added- checkbox and from now on every time a comment is added I recieve four emails with the exact same comment. Perhaps there is an easy method you can remove me from that service? Thanks.
Hi there, I believe your blog could be having browser compatibility issues. When I take a look at your site in Safari, it looks fine but when opening in Internet Explorer, it’s got some overlapping issues. I merely wanted to give you a quick heads up! Besides that, great blog.
Spot on with this write-up, I truly think this amazing site needs much more attention. I’ll probably be returning to see more, thanks for the advice!
I used to be able to find good information from your blog articles.
Oh my goodness! Amazing article dude! Thanks, However I am experiencing problems with your RSS. I don’t know the reason why I cannot subscribe to it. Is there anybody having similar RSS issues? Anyone that knows the answer will you kindly respond? Thanks!
I couldn’t resist commenting. Well written!
I truly love your website.. Excellent colors & theme. Did you create this website yourself? Please reply back as I’m planning to create my very own website and want to learn where you got this from or exactly what the theme is named. Many thanks!
After I initially left a comment I appear to have clicked on the -Notify me when new comments are added- checkbox and now whenever a comment is added I get four emails with the same comment. Is there an easy method you can remove me from that service? Appreciate it.
I like it when individuals get together and share ideas. Great website, stick with it.
You have made some really good points there. I checked on the internet for additional information about the issue and found most people will go along with your views on this website.
Hi, I do think this is a great web site. I stumbledupon it 😉 I am going to come back yet again since I saved as a favorite it. Money and freedom is the best way to change, may you be rich and continue to guide others.
It’s difficult to find knowledgeable people for this subject, however, you sound like you know what you’re talking about! Thanks
This web site certainly has all the information and facts I wanted concerning this subject and didn’t know who to ask.
Pretty! This has been an incredibly wonderful article. Thanks for providing this info.
There’s certainly a lot to find out about this subject. I like all the points you’ve made.
Hi there! I could have sworn I’ve visited this blog before but after going through a few of the articles I realized it’s new to me. Anyways, I’m definitely delighted I discovered it and I’ll be book-marking it and checking back regularly!
Saved as a favorite, I like your website!
I have to thank you for the efforts you’ve put in penning this blog. I really hope to view the same high-grade blog posts from you in the future as well. In fact, your creative writing abilities has encouraged me to get my very own site now 😉
It’s difficult to find knowledgeable people on this subject, but you sound like you know what you’re talking about! Thanks
I’m pretty pleased to discover this web site. I wanted to thank you for your time just for this wonderful read!! I definitely enjoyed every part of it and I have you book-marked to check out new things in your blog.
You’re so cool! I don’t believe I’ve truly read through anything like that before. So good to find someone with some genuine thoughts on this subject matter. Really.. thanks for starting this up. This website is something that’s needed on the internet, someone with a little originality.
That is a very good tip particularly to those new to the blogosphere. Short but very precise info… Many thanks for sharing this one. A must read post.
Can I simply say what a relief to uncover someone who actually knows what they’re talking about over the internet. You actually know how to bring an issue to light and make it important. A lot more people really need to check this out and understand this side of your story. I was surprised that you’re not more popular since you definitely possess the gift.
Your style is unique in comparison to other people I have read stuff from. Many thanks for posting when you’ve got the opportunity, Guess I’ll just bookmark this web site.
Very good write-up. I definitely appreciate this website. Stick with it!
Good information. Lucky me I discovered your blog by chance (stumbleupon). I have saved as a favorite for later.
Very good post. I definitely love this site. Thanks!
After looking at a few of the blog posts on your web page, I truly appreciate your way of blogging. I saved it to my bookmark website list and will be checking back soon. Take a look at my website as well and tell me what you think.
This page definitely has all of the info I needed concerning this subject and didn’t know who to ask.
Very good information. Lucky me I ran across your site by accident (stumbleupon). I’ve saved as a favorite for later!
Wonderful article! We are linking to this particularly great content on our website. Keep up the good writing.
I blog frequently and I seriously thank you for your content. The article has really peaked my interest. I am going to bookmark your blog and keep checking for new information about once per week. I opted in for your Feed too.
I couldn’t refrain from commenting. Exceptionally well written!
Good post. I learn something totally new and challenging on websites I stumbleupon on a daily basis. It’s always useful to read articles from other authors and use a little something from their websites.
Can I simply just say what a relief to discover someone who really knows what they are talking about on the internet. You certainly understand how to bring an issue to light and make it important. A lot more people ought to read this and understand this side of the story. I was surprised you aren’t more popular given that you definitely have the gift.
Great info. Lucky me I discovered your site by chance (stumbleupon). I’ve book-marked it for later!
I couldn’t refrain from commenting. Well written.
Excellent post. I am dealing with some of these issues as well..
Greetings! Very helpful advice in this particular article! It is the little changes which will make the largest changes. Thanks a lot for sharing!
May I simply say what a relief to uncover an individual who actually knows what they are discussing online. You actually know how to bring a problem to light and make it important. More and more people need to look at this and understand this side of your story. I was surprised that you are not more popular because you surely have the gift.
Way cool! Some extremely valid points! I appreciate you writing this article plus the rest of the website is extremely good.
It’s difficult to find knowledgeable people about this subject, however, you sound like you know what you’re talking about! Thanks
Hi there, There’s no doubt that your site might be having internet browser compatibility problems. When I look at your site in Safari, it looks fine however, if opening in IE, it’s got some overlapping issues. I simply wanted to provide you with a quick heads up! Other than that, great website!
This blog was… how do you say it? Relevant!! Finally I’ve found something that helped me. Thanks a lot!
This is one awesome blog post.Much thanks again. Keep writing.
I really like it when people get together and share opinions. Great website, stick with it.
I love it whenever people get together and share thoughts. Great website, continue the good work.
A motivating discussion is worth comment. I believe that you need to write more about this subject matter, it may not be a taboo subject but usually folks don’t discuss these issues. To the next! Many thanks.
You need to take part in a contest for one of the most useful sites on the internet. I am going to recommend this web site!
When I initially left a comment I seem to have clicked the -Notify me when new comments are added- checkbox and now whenever a comment is added I recieve four emails with the exact same comment. Is there an easy method you can remove me from that service? Many thanks.
It’s hard to find educated people for this subject, but you sound like you know what you’re talking about! Thanks
You have made some really good points there. I checked on the net to learn more about the issue and found most individuals will go along with your views on this site.
This is a really good tip particularly to those fresh to the blogosphere. Short but very precise info… Appreciate your sharing this one. A must read article!
bookmarked!!, I like your site!
Gain insights into On-Chain Crypto Mining with a clear breakdown of supply structure, incentives, and participation design. Learn how to assess whether a token’s scarcity story can hold up long-term.