2014年11月25日より、これまでの薬事法を一部改正した「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(薬機法)が施行された。
これに伴い、医療機器の製造業が許可制から登録制へと緩和される一方、製造販売業はQMS省令の対象となるなど、大きな変更が実施された。
薬機法のポイントはこちら。
本記事に関する最新情報はこちら。
製造販売業
医療機器を市場に出す事業者(製造販売業者。輸入業者も含まれる。)は、医療機器の製造販売業許可を取得することになる。
医療機器を日本国内市場に出すにあたっては、医療機器の品質が保証され、ユーザや患者、医療関係者等の安全が確保されるものでなければならない。
そのため、薬機法では、製造販売業許可の要件として、品質保証と安全管理の体制を整えることが求められている。
医療機器製造販売業許可は、「事業者」が取得する。
一法人にひとつの許可。(第1種医療機器製造販売業許可と第3種医療機器製造販売業許可を同時に持つことはない。)
複数の営業所がある場合は、総括製造販売責任者の常駐する事業所(本社等)がある都道府県知事に、許可を申請する。
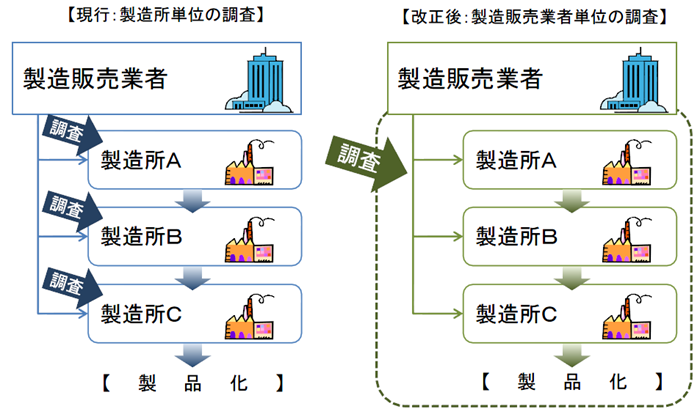
薬機法施行後は、製造販売業がQMS省令の対象となる。
従来のように製造所毎に別個に調査・判定をするのではなく、製造販売業者に対して、品質システム全体を包括的に調査・判定することになった。
製造販売業者の責任業務
製造販売業者は、次に掲げる業務を行わなければならない。
- QMSに必要な工程の内容(当該工程により達成される結果を含む。)を明らかにするとともに、当該工程のそれぞれについて、各施設の関与の態様を明確にすること。
- 工程の順序および相互の関係を明確にすること。
- 工程の実施および管理の実効性の確保に必要な判定基準および方法を明確にすること。
- 工程の実施、監視および測定に必要な資源および情報が利用できるようにすること。
- 工程を監視し、測定し、および分析すること。
- 工程について、1.の結果を得るために、および実効性を維持するために所要の措置を採ること。
体制の整備(体制省令およびGVP省令への適合)
国は、医療機器又は体外診断用医薬品の製造管理又は品質管理に係る業務を行う体制の基準(体制)、製造管理及び品質管理の基準(QMS)、医療機器の市販後安全管理に関する基準(GVP)を、省令として公布している。 医療機器の製造販売業許可業者は、これらの省令にしたがって、適切に、医療機器の品質管理・安全管理を行わねばならない。 その体制が整っていることが、「許可の取得」「許可の維持」の要件である。

製造販売業許可を取得する場合、管理監督者(経営者)、管理責任者の他に、いわゆる三役(医療機器等総括製造販売責任者、国内品質業務運営責任者、医療機器等安全管理責任者)を置かなければならない。
また製造業の登録申請を行う場合、責任技術者を置かなければならない。
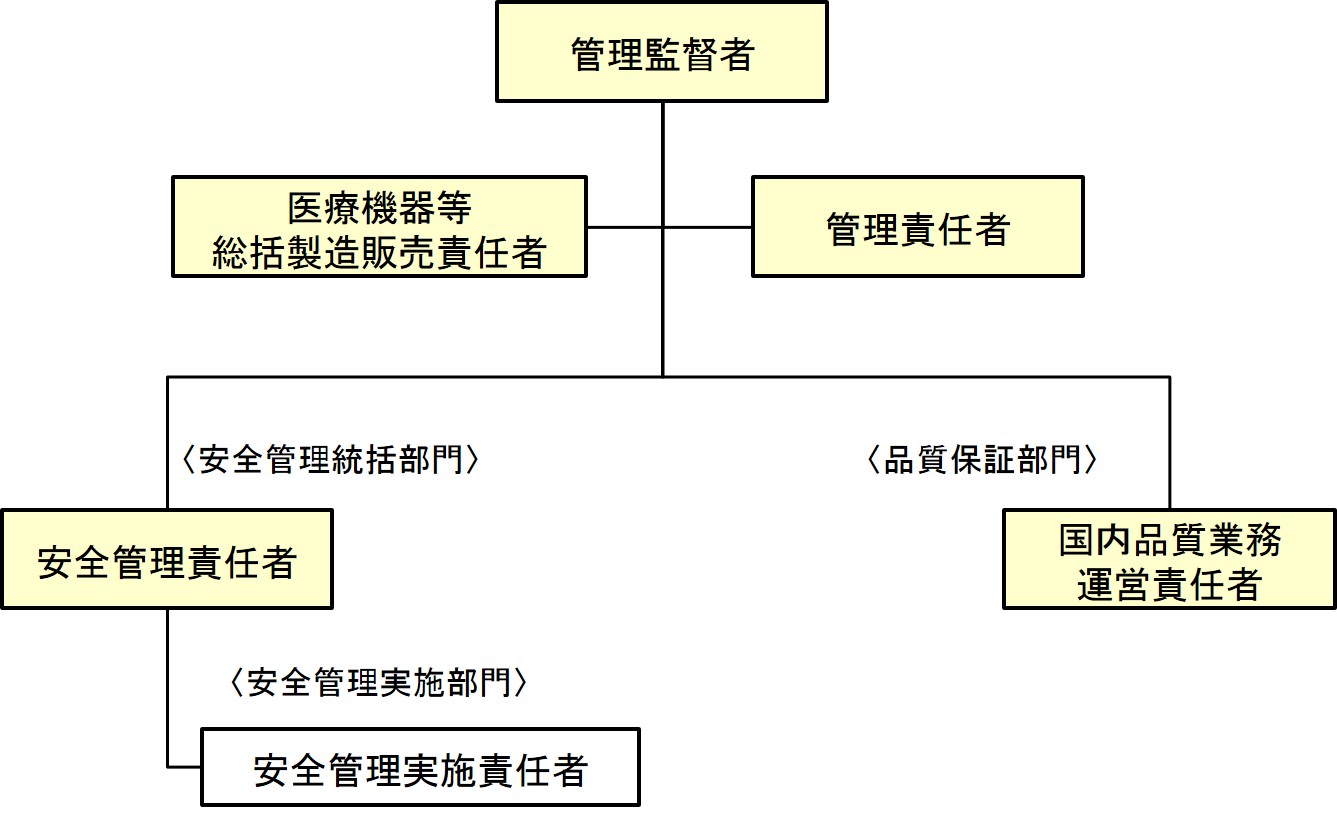
管理責任者
管理責任者は、製造販売業者等の役員、管理職の地位にある者その他これに相当する者がその任につくこと。
管理責任者の責任及び権限
- 工程が確立され、実施されるとともに、その実効性が維持されているようにすること。
- 品質管理監督システムの実施状況及びその改善の必要性について管理監督者に報告すること。
- 全ての施設において、法令の規定等及び製品受領者要求事項についての認識が向上するようにすること。
医療機器等総括製造販売責任者の業務
医療機器等総括製造販売責任者は、管理監督者、管理責任者、国内品質業務運営責任者を兼ねることができる。
- 製品の出荷の決定その他の製造管理及び品質管理に係る業務を統括し、これに責任を負うこと。
- 業務を公正かつ適正に行うために必要があると認めるときは、製造販売業者、管理監督者その他の当該業務に関して責任を有する者に対し文書により必要な意見を述べ、その写しを五年間保管すること。
- 国内品質業務運営責任者を監督すること。
- 管理責任者及び国内品質業務運営責任者(限定第三種医療機器製造販売業者にあっては、管理責任者を除く。)の意見を尊重すること。
- 安全管理統括部門との密接な連携を図らせること。
医療機器等総括製造販売責任者の要件
- クラス2以上(施行規則第114条の49第1項)高度管理医療機器又は管理医療機器の製造管理及び品質管理並びに製造販売後安全管理を行う者に係る法第23条の2の14第1項の厚生労働省令で定める基準は、次の各号のいずれかに該当する者であること。
- 大学等で物理学、化学、生物学、工学、情報学、金属学、電気学、機械学、薬学、医学又は歯学に関する専門の課程を修了した者
- 旧制中学若しくは高校又はこれと同等以上の学校で、物理学、化学、生物学、工学、情報学、金属学、電気学、機械学、薬学、医学又は歯学に関する専門の課程を修了した後、医薬品、医療機器又は再生医療等製品の品質管理又は製造販売後安全管理に関する業務に3年以上従事した者
- 医薬品、医療機器又は再生医療等製品の品質管理又は製造販売後安全管理に関する業務に5年以上従事した後、別に厚生労働省令で定めるところにより厚生労働大臣の登録を受けた者が行う講習を修了した者
四 厚生労働大臣が前3号に掲げる者と同等以上の知識経験を有すると認めた者
- クラス1(規則第114条の49第2項)
一般医療機器の製造管理及び品質管理並びに製造販売後安全管理を行う者に係る法第23条の2の14第1項の厚生労働省令で定める基準は、次の各号のいずれかに該当する者であることとする。
- 旧制中学若しくは高校又はこれと同等以上の学校で、物理学、化学、生物学、工学、情報学、金属学、電気学、機械学、薬学、医学又は歯学に関する専門の課程を修了した者
- 旧制中学若しくは高校又はこれと同等以上の学校で、物理学、化学、生物学、工学、情報学、金属学、電気学、機械学、薬学、医学又は歯学に関する科目を修得した後、医薬品、医薬部外品、化粧品、医療機器又は再生医療等製品の品質管理又は製造販売後安全管理に関する業務に3年以上従事した者
- 厚生労働大臣が前2号に掲げる者と同等以上の知識経験を有すると認めた者
国内品質業務運営責任者の業務
国内品質業務運営責任者は、管理責任者を兼ねることができる。
- 国内の品質管理業務を統括すること。
- 国内の品質管理業務が適正かつ円滑に行われていることを確認すること。
- 国内に流通させる製品について、市場への出荷の決定をロット(製造番号又は製造記号)ごとに行い、その結果及び出荷先等市場への出荷の記録を作成すること。
- 国内に流通する製品について、当該製品の品質に影響を与えるおそれのある製造方法、試験検査方法等の変更がなされる場合にあっては、当該変更に係る情報を国内外から収集し、かつ、把握するとともに、当該変更が製品の品質に重大な影響を与えるおそれがある場合には、速やかに管理責任者及び医療機器等総括製造販売責任者に対して文書により報告し、必要かつ適切な措置が採られるようにすること。
- 国内に流通する製品について、当該製品の品質等に関する情報(品質不良又はそのおそれに係る情報を含む。)を国内外から収集するとともに、当該情報を得たときは、速やかに管理責任者及び医療機器等総括製造販売責任者に対して文書により報告し、記録し、及び必要かつ適切な措置が採られるようにすること。
- 国内に流通する製品の回収を行う場合に、次に掲げる業務を行うこと。
イ 回収した医療機器等を区分して一定期間保管した後、適正に処理すること。
ロ 回収の内容を記載した記録を作成し、管理責任者及び医療機器等総括製造販売責任者に対して文書により報告すること。 - 第4号から前号までに掲げるもののほか、国内の品質管理業務の遂行のために必要があると認めるときは、管理責任者及び医療機器等総括製造販売責任者に対して文書により報告すること。
- 国内の品質管理管理業務の実施に当たり、必要に応じ、関係する登録製造所に係る製造業者又は医療機器等外国製造業者、販売業者、薬局開設者、病院及び診療所の開設者その他関係者に対し、文書による連絡又は指示を行うこと。
- 製造販売後安全管理基準第二条第二項に規定する安全確保措置に関する情報を知ったときは、安全管理統括部門に遅滞なく文書で提供すること。
国内品質業務運営責任者の要件
製造販売業者は、この省令の規定に従って行う国内の製品の品質を管理する業務の責任者として、国内に所在する施設に、次に掲げる要件を満たす国内品質業務運営責任者を置かなければならない。
- 製造販売業者における品質保証部門の責任者であること。
- 品質管理業務その他これに類する業務に三年以上従事した者であること。
- 国内の品質管理業務を適正かつ円滑に遂行しうる能力を有する者であること。
- 医療機器等の販売に係る部門に属する者でないことその他国内の品質管理業務の適正かつ円滑な遂行に支障を及ぼすおそれがない者であること。
注)国内品質業務運営責任者は、従前のQMS省令では、品質保証責任者と呼んでいた。改正法では、医薬品と医療機器を区別したため、医療機器における名称が変更になった。企業は、今後ともSOPなどで品質保証責任者と呼んでも構わない。
安全管理責任者
第一種製造販売業者は、次に掲げる要件を満たす安全確保業務の統括に係る部門(以下この章において「安全管理統括部門」という。)を置かなければならない。
- 総括製造販売責任者の監督下にあること。
- 安全確保業務を適正かつ円滑に遂行しうる能力を有する人員を十分に有すること。
- 医薬品等の販売に係る部門その他安全確保業務の適正かつ円滑な遂行に支障を及ぼすおそれのある部門から独立していること。
第一種製造販売業者は、次に掲げる要件を満たす安全確保業務の責任者(以下この章において「安全管理責任者」という。)を置かなければならない。
- 安全管理統括部門の責任者であること。
- 安全確保業務その他これに類する業務に三年以上従事した者であること。
- 安全確保業務を適正かつ円滑に遂行しうる能力を有する者であること。
- 医薬品等の販売に係る部門に属する者でないことその他安全確保業務の適正かつ円滑な遂行に支障を及ぼすおそれがない者であること。
- 第一種製造販売業者は、次項に規定する場合を除き、安全管理責任者に安全確保業務を行わせなければならない。
- 第一種製造販売業者は、安全確保業務であって規則第九十七条 各号に掲げるものの全部又は一部を安全管理責任者以外の者に行わせる場合にあっては、当該業務を適正かつ円滑に遂行しうる能力を有する当該業務の実施に係る責任者(以下「安全管理実施責任者」という。)を置かなければならない。
QMSの構築
製造販売業者は、新QMS省令にもとづき、QMSの構築を行わなければならない。

QMS適合性調査
薬機法施行後のQMS適合性調査は、製造販売業のQMSのもと、PMDAまたは登録認証機関が調査を実施する。(適合性調査を受けるのは製造販売業者+製造業者)
*QMS=企業がシステム(組織体制やルール)を確立し、製造に関わる組織全体で品質保証(製造管理及び品質管理)すること。
製造業
医療機器(ソフトウェアを含む)を製造する場合は、製造業として登録の申請(薬機法第二十三条の二の三第一項)を行う必要がある。登録の有効期限は5年間である。
医療機器やソフトウェアの設計を行う者も製造業の登録が必要であるため注意が必要である。
登録制への移行に伴い、登録申請時に添付する資料が簡素化された。
医療機器とされるソフトウェア(例:診断用ソフトウェア)を設計・開発・製造する業者も製造業の登録が必要である。経過措置として、登録対象製造所ごとに、施行日から起算して3か月以内に登録の申請をしなければならない。
すでに製造業許可を受けている製造所は、自動的に登録されるため、許可期限の残日数は何もしなくてもよい。許可更新予定日までに新たに登録することとなる。
【現行】すべて許可制 【改正後】医療機器、体外診断用医薬品は登録制へ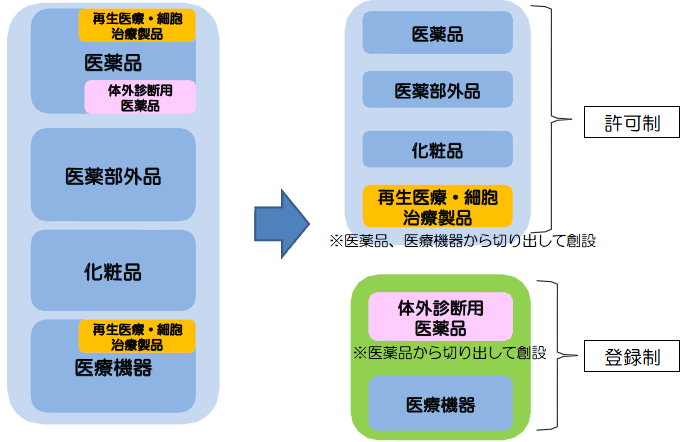
従来、許可申請時には所管都道府県によるQMS適合性調査が実施されていたが、薬機法施行後は、登録時に調査が行われることはない。
tablet for allergy on skin what is allergy medicine called names of prescription allergy pills
Asking questions are actually good thing if you are not understanding
something entirely, but this paragraph gives nice understanding yet.