【連載】ISO-13485:2016対応の要点
【第2回】品質マネジメントシステム
品質マネジメントシステムとは
ISO-13485:2016の第4章では「品質マネジメントシステム」についての要求事項が記載されている。
4 品質マネジメントシステム
4.1 一般要求事項
4.2 文書化に関する要求事項
4.2.1 一般
4.2.2 品質マニュアル
4.2.3 医療機器ファイル
4.2.4 文書管理
4.2.5 記録の管理
ISO-13485の箇条で最も大事な要件を集めた章であると筆者は考えている。
なお品質マネジメントシステム(QMS:Quality Manegement System)は、FDAの場合品質システム(QS:Quality System)と呼んでいる。それらの意図はまったく同じである。
ISO-9000では、「品質マネジメントシステム」を次のように定義している。
(a)品質マネジメント(Quality Management)
「品質に関して組織を指揮し、管理するための調整された活動」
品質に関する指揮及び管理には、通常、品質方針及び品質目標の設定、品質計画、品質管理、品質保証及び品質改善が含まれる。
(b)品質管理
「品質要求事項を満たすことに焦点を合わせた品質マネジメントの一部」
つまり、品質管理とは「買手の要求に合った品質の品物またはサービスを経済的に作り出すための手段の体系」である。
- 顧客に提供する品物やサービスが顧客の要求する品質(Quality)、価格(Cost)、納期(Delivery)になっていること。
- 品物やサービスをなどを各職場や部署で他社より安く早く効率よく提供できること。
- それらを行うために、固有技術だけではなく統計を利用した管理技術を全社的におこなうこと。
ISO-13485では、品質管理をQC(Quality Control)ではなく広義にとらえて「顧客や規制要件の要求する仕様・品質を満たし、ニーズにあった製品やサービスを作って提供するための品質管理活動」という意味合いでとらえている。
「TQM」(総合的品質管理)/「TQC」(全社的品質管理)などと同様である。
また品質を管理する対象は、製品またはサービスだけではなく、そのプロセスも含まれる。
つまり、企業全体で品質管理をおこなう。
顧客の要求事項、製品の企画、開発、設計、量産移行、購買、アウトソース、製造、検査、出荷、販売、およびアフターサービスなどの全部門で品質管理活動を進めてゆく必要がある。
QMSにおけるPDCAサイクル
品質マネジメントシステム(QMS)では、以下の4つのPDCAサイクルを定義するのが一般的である。
1.マネージメントプロセス
2.リソースプロセス
3.製品実現プロセス
4.測定・分析および改善プロセス
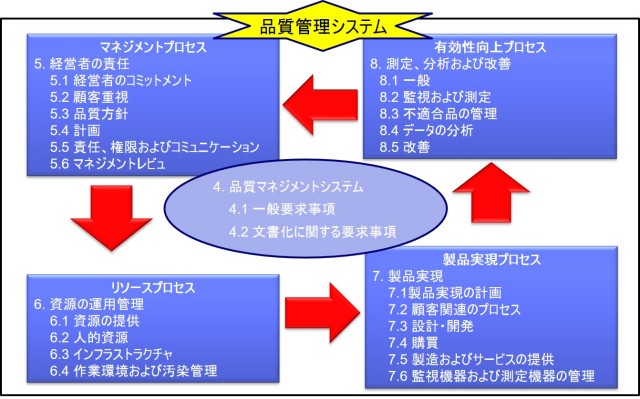
図1 ISO-13485:2016におけるPDCAサイクル
マネジメントプロセス
マネージメントプロセスでは、経営者が品質方針を作成し、また年度毎に品質目標をたてる。
品質目標では、達成可能な目標であることと、具体的な数値とともにその達成基準が明確になっていなければならない。例えば、顧客苦情を3ポイント減少させる、逸脱を5ポイント下げる、顧客満足度を10ポイント増加させるなどである。
また、定期的にマネジメントレビュを実施し、品質改善に関する適切な指示を出さなければならない。
リソースプロセス
リソースプロセスでは、経営者は適切なリソース(人、モノ、金)をあてがわなければならない。
口頭で指示するだけでリソースを準備しなければ、品質改善が実行できないからである。
例えば、要員を雇用する、教育訓練を実施する、コンサルタントを雇うなどである。
製品実現プロセス
製品実現プロセスでは、QMSに従って、研究・開発・設計・製造・流通・サービス等を実施する。
その目的は、ユーザニーズ(要求)に合致した製品を市場に出荷し、顧客満足度を得ることである。
測定・分析および改善プロセス
測定・分析および改善プロセスでは、顧客苦情などの収集を行い、再発防止に向けた是正処置・予防処置を行う。
是正処置で重要なことは、問題の根本的原因を調査し、それを解消することにより、再発を防止することである。是正と修正は異なることに注意が必要である。
また内部監査を実施し、潜在している問題点(つまりリスク)を自ら発見することである。
なお内部監査は「Self Inspection」(自主的な査察)と呼ばれている。Self Inspectionは、日本の省令等では「自己点検」と訳されているが、この用語は適切ではない。
Self Inspectionでは、企業自らの内部監査等によって、日々リスクを発見し、是正・予防することが重要である。つまり当局査察で指摘されるのを待って改善するのではなく、企業自らが積極的に改善活動を実施するのである。
是正処置・予防処置や内部監査の結果は、マネージメントプロセスにフィードバックし、マネジメント(経営者)が、マネジメントレビュなどによって改善指示を出したり、次年度の品質目標をたてることになる。
品質マネジメントシステム
こういった品質改善の仕組みを「品質マネジメントシステム(QMS)」と呼ぶ。品質マネジメントシステム(QMS)はPDCAが基本である。
PDCAサイクルをもったQMSが存在するということは、今日よりも明日、明日よりも明後日は品質が向上するといった保証が存在するということである。
FDAによる品質システム査察
FDAは品質システム(QS)の確立はトップマネジメント(経営者)の責任と位置付けている。
医療機器企業がグローバル化を促進する中、FDAをはじめ海外の規制当局の査察を受ける機会が多くなった。
一方で規制当局は、サプライチェーンがグローバル化していることに伴い、海外査察の回数を増やしている。
しかしながら、査察にかけることができるリソースは限られているため、効率的な査察手法が必要である。
従来の査察では、査察官から指摘された事項を是正しておけば、容認されてきた。
しかしである。わずか数日の査察(医療機器に対するFDA査察は日本においては4日間)で査察官が発見することができる問題点・リスクは数が限られている。
したがって、査察官が発見したエラー(リスク)に対して是正を行えば自国民の安全が守られるということにはならない。
そこでFDAなどの査察では、エラー(リスク)を発見する査察手法から、当該企業が経営者のガバナンス(統治)のもと『品質システム(Quality System)』を確立しているかどうかを調査するといった手法に切り替えている。
FDA等の査察では、企業自らが品質システム(QS)を確立しており、査察が実施されていなくとも査察官と同様の目線(レベル)で指摘・改善活動が実施されていることを確認するのである。
そのためには優秀な監査要員の確保が最重要である。
品質システム(QS)が確立されている企業は、査察官にとって「安心」できる企業であるといえる。
I am no longer certain the place you are getting your information, however good topic.
I needs to spend some time studying much more or figuring out more.
Thank you for excellent info I was looking for this information for
my mission.
Very descriptive post, I liked that a lot. Will there be a part 2?
Generally I do not read article on blogs, however I would
like to say that this write-up very forced me to take a look
at and do so! Your writing taste has been surprised me.
Thanks, quite great article.
Hmm is anyone else having problems with the pictures on this blog loading?
I’m trying to find out if its a problem on my end
or if it’s the blog. Any suggestions would be greatly appreciated.