承認を早期に取得するためには「申請戦略」から各設計文書を整備する必要がある
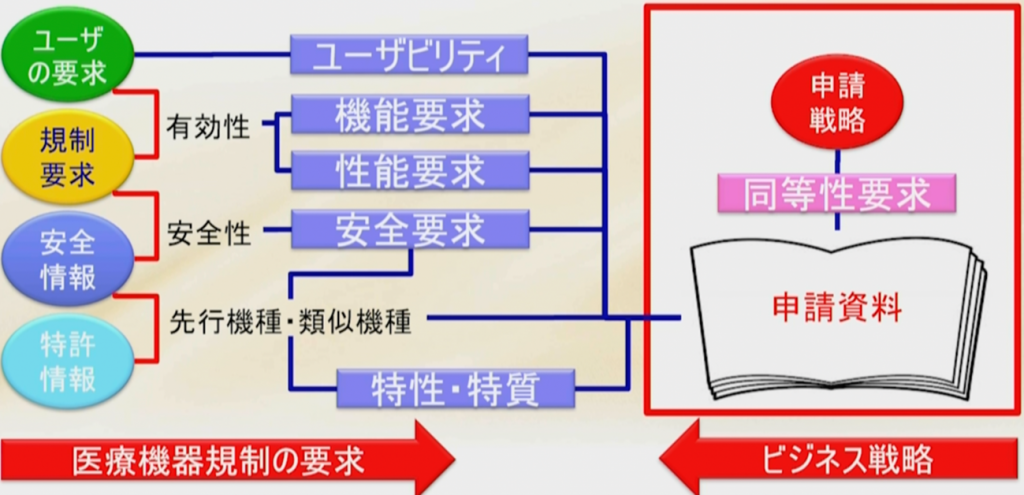
医療機器メーカーには、品目の承認または認証を早期に取得したいという要求があり、どうやれば申請がうまくいくか?早く通せるか?ということに注意が向くものだが、まずやらなければならないことは申請戦略を作ることである。
その申請戦略に基づいて、エビデンスを揃えて、申請資料を作らなければならないのである。
先の章で紹介したように、ユーザーの要求を集め、規制要求を集めて有効性を証明する、安全情報から来る安全要求で安全性を証明する。
さらに先行機種や類似機種に比べて特性・特質があるので、既に世の中に出ている機器または他社品、類似品に対してどんな特徴があるか特性があるかを出す。
新たな特性・特質により、前のものと性能の違う機能を持たせると新たにハザードが生まれ、新たに生まれるリスクをマネージメントする必要が出てくる。
少なくとも先行品に対して同等性を評価しなければならないし、同等以上のものでなければならない。
申請をする段になってこの試験が足りない、あの試験が足りないということにならないように、例えば改良医療機器として申請しようとしているのに新しい機能を付け加えてしまった、それによって新規医療機器になってしまったとか、クラスIIで抑えようと思ったのに、気がついたらクラスⅢになってしまっていた、などということがないようにしなければならない。
方針 (Step1) 〜申請資料〜
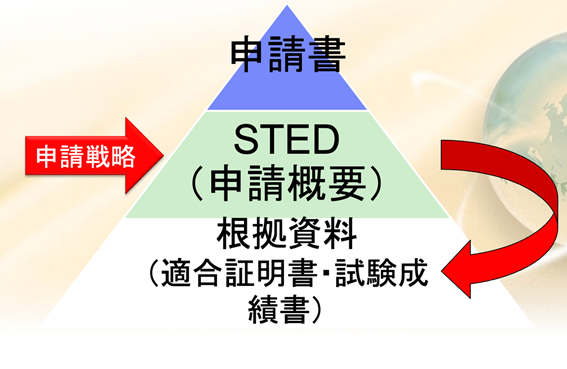
申請資料は、まず鏡として申請書がある。その下にステッドっていうものがある、これが申請概要である。
認証を受ける場合も承認を受ける場合も、このステッドを必ず書かなければならない。
このステッドというのは、サマリー文書のことをいう。
テクニカルドキュメントのサマリー文書は、日本語で言うと申請概要と言われるものである。
設計部門は、色々な設計資料、設計文書や仕様書であるとかまたはテストの記録、または外部試験機関による試験結果、成績証明書等を集めているが、それらすべてを認証申請の時に出すわけではない。
大事なことは、それらを集めた申請概要を書かなければならないということである
その申請概要の書き方、ステッドの書き方というのは当局から出ている。書き方の例というのがでているので、それを参照し作成する。
その根拠資料たるテクニカル文書(設計文書)は、いつ見られるかというと、申請をして、ステッドを見て。当局の方で信頼性調査を選ぶ。例えば二つ選ばれ、この資料を見せてください、次はこの資料を見せてくださいという風にランダムに選ばれる。どの資料を見せてくれと言われるか分からないので、すべての資料を取り揃えておかなければならない。
もし当局からの調査依頼に対して資料がなかった場合、慌てて作ったとしても間に合わない。医療機器の承認審査の期間というのは期限が決められており、その間に必要な資料が出せないと、申請が却下になってしまうということもあるので気をつけなければならない。
こういった根拠資料、多くの仕様書、そしてテスト結果、検証の記録、試験の成績書、これらの物を集めて、それをサマリーした文書がステッドと呼ばれるもので、このステッドを申請戦略に基づいて書くということが申請資料を作るということに相当する。
PMDA申請における調査対象
でここで気をつけていただきたいことなのですけど
ではどういう調査を受けるかということなのですね
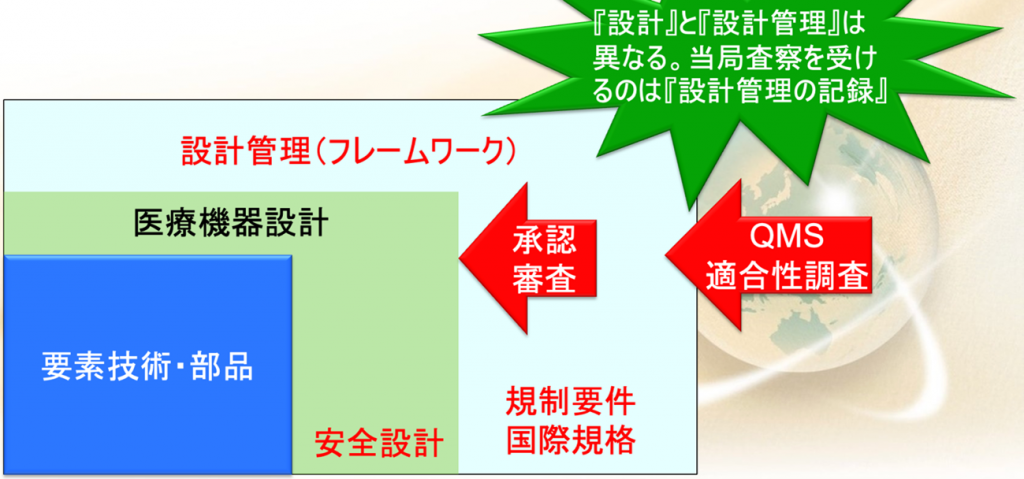
昨今は大学が要素技術を持っていることがある。
例えばソフトウェアのアルゴリズムだけあるなどするのだが、アルゴリズムだけあっても、実際には文書がないので、それでは設計したということにならない。
またもう一つは、この要素技術はどちらかといえば有効性の方で、安全設計はされてないことが多い。
そこで必要なのは図の青色に書いた要素技術をさらに拡大した、医療機器設計、医療機器に大事なことは安全設計なので、グリーンのエリアまで広めなければならないということなのだ。
さらに規制要件とか国際規格に沿ってその設計を管理しなければならない。
これを設計管理(フレームワーク)と言う
後述するが、設計と設計管理の違いを分かってない方が非常に多い。
設計と設計管理は異なるのである。
まず承認や認証で見られるのが、この医療機器設計の部分になる。
特に設計資料の中で、どんな機能で、どういう仕様で、どんな性能で、その結果がどうであって、ということと
もう一つは、安全設計が正しくされて、リスクが回避されている、リスクが低減されているかということである。
これを審査して、当該の医療機器は有効性・安全性がある、という結論になる。
で、もう一つ大事なことは、このQMS適合性調査というのが行われます
これは設計管理が対象になる。
設計と設計管理の違いについて述べる
医療機器の「設計」というのは、その医療機器そのものの有効性・安全性の審査のために必要となる。
一方で「設計管理」というのは、設計計画書を作ったか、計画書を遵守したか、結果が管理され、結果が記録として残っているか、当然内容が改ざんされていないこと、正しいこと
そういうことも管理しなければならない。
設計検証とかデザインレビューも設計審査が行われていて設計審査をする人が力量のない人では意味がない。素人がレビューしても決して品質の良い医療機器にはならないし、安全性の高い医療機器にならない。この設計審査に加わった人は誰であって、力量がどれくらいあるということを管理し記録に残っているかどうか、設計バリデーションを行って、臨床評価を行って、場合によっては臨床試験を行って、正しく管理されているかどうか、記録が残っているかどうか監査する。これをQMS適合性調査という。
「設計」は審査承認されるもの。「設計管理」はQMS適合性調査で査察されるもの、監査されるものという風にご理解いただきたい。
QMS省令で規制されているのは設計管理であって設計ではないので、そこをよく聞き分けていただきたい。
多くの場合は設計管理がうまくいってない。ISO-13485とかQSRとか、またはQMS省令に従った設計管理がうまくできていないということが多いので気をつけていただきたい。
日本の医療機器のクラス分類と承認要件・QMS調査要件
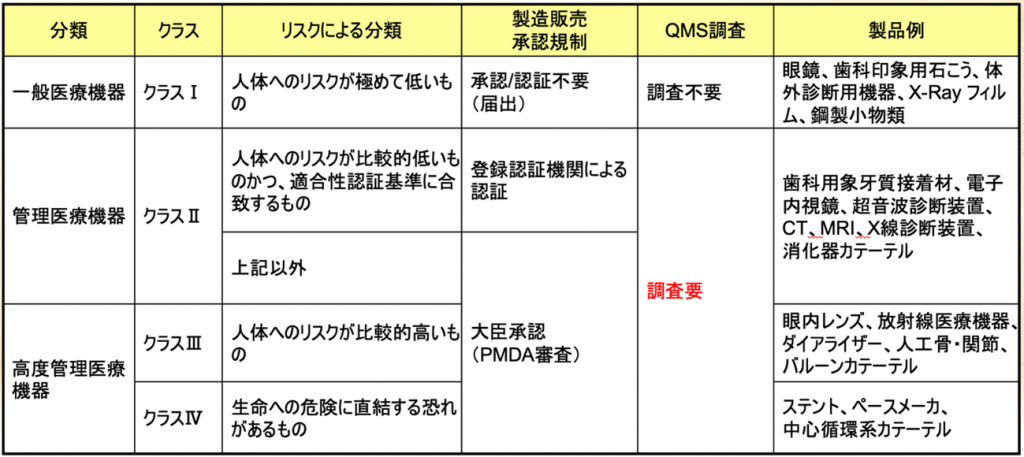
日本の医療機器のクラス分類と承認要件、QMS調査の要件を図でご覧いただきますと
一言です、クラスIを除けば、クラスIIとクラスⅢ、クラスⅣともにQMS適合性調査が必須であるということである。
2015年の薬事法の一部改正によって薬機法になったが、薬機法になって以降、QMS適合性調査は製販に入ることになった。
製販が製造業を監視監督していることを確認する。製販は各製造業者が持っている製品標準書集めて管理しておくことが原則である。
例えばメカは神奈川県で作っている、エレキは群馬県で作っている、ソフトウェアーは千葉県で作っているとする、そうするとメカだけ、エレキだけ、ソフトだけを監査をしても安全性・有効性が確認できない、品質が確認できない。医療機器として組上がって初めて品質が担保されているという事が確認できるので、QMSの適合性調査は製販に入るということになった。
製販に入って、そこから製造業者、これは主に最終組立工場(医療機器としてもう出荷すれば動くものに仕上げる工程のこと)、滅菌前でも相当するし、梱包とか滅菌前のもの、最終医療機器として動作する形にするところに対して実地調査が入ることがある。
実地調査があるかないかというのは当局のみぞ知るということなのだが、ISO-13485を取得していると実地調査が省略されることがある。もちろん省略されない場合も当然ある。
医療機器の民間の第三者機関による認証制度
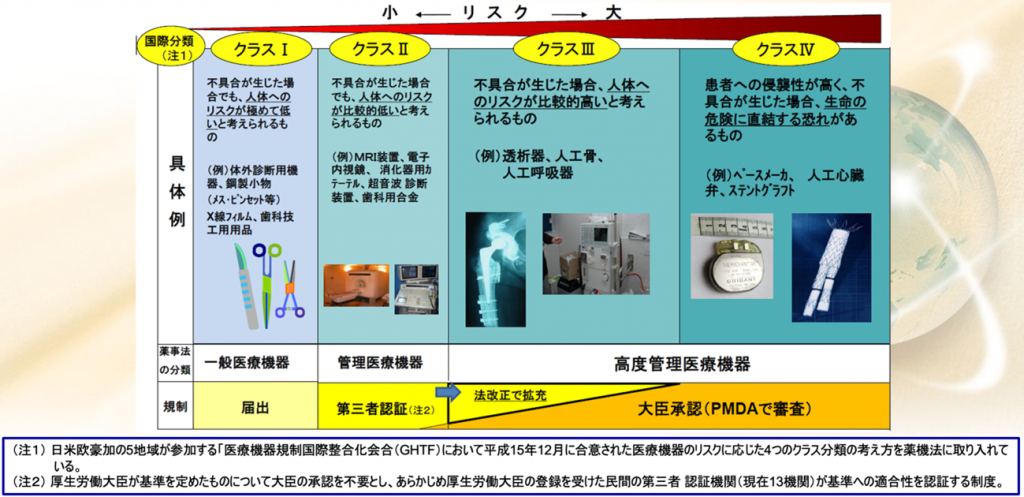
薬機法になってから、医療機器も承認権者が多少変わった。
品目に関しては、都道府県庁の監査というのはなくなった。
管理医療機器クラスIIは主に第三者認証になる。
クラスⅢは大臣承認ですから主にPMDAが審査することになっているが、一部のクラスIIは承認が必要になることがある。
逆に一部のクラスⅢの製品、例えば、もう枯れた製品、コンタクトレンズとかインプラントこういうものはクラスⅢ、要するに侵襲度が高かったり、接触時間が長かったりするのでクラスは高いけれども、安全性が十分に確認されているので第三者認証になったものもある。
一方で認証基準がない新規医療機器に関しては、クラスIIであってもPMDAの大臣承認
になるということもあり得る。日本はこのように承認権者が二つある。国・PMDAと第三者認証機関である。
アメリカは、ほぼ100%を当局FDAが審査をする。
一方でヨーロッパ100%第三者認証機関が認証する。しかもヨーロッパの場合は自己認証が基本で、当局は一切関与しない。
この違いは何かと言うと、承認権者が刑事訴追を受けるか受けないかなのである。
日本とアメリカは承認という制度があるのだが、その代わり、もしそれで万が一何らかの刑事訴追を患者の方から受けることになった場合は、国が成り代わって被告になるというのがこの承認という制度なのである。
一方ヨーロッパでは規制当局が一切この承認という行為に携わらない。 もし事故が起きた場合は当事者間で解決する。裁判を受けて立つというのがヨーロッパの制度なのだ。全て民間が認証するという制度になっており、日米とヨーロッパ欧州では考え方が全く違うということもご紹介しておきたい。
お役立ち動画
医療機器の設計・開発・申請における規制要件入門
~品質、有効性及び安全性の確保~
▶ 1講 医療機器と規制要件
▶ 2講 医療機器の種類
▶ 3講 医療機器と品質
▶ 4講 医療機器と安全性
▶ 5講 医療機器と有効性
▶ 6講 医療機器申請と当局査察
関連商品
[blogcard url=”https://ecompliance.co.jp/SHOP/QMS-LIVE.html” title=”(全16講)医療機器QMS規制入門セミナー【一括受講コース】” content=”医療機器企業に初めて入社・転職した人向けの規制要件入門コースです。QMSを中心に解説を行います。
本邦では、医療機器企業(製造販売業)においては、QMS省令(体制省令)およびGVP省令に則った体制の構築が出来ていなければなりません。
またQMS省令に従って、QMS(Quality Management System:品質管理システム)が文書化されており、適切にQMSに従って運用されており、それら活動の記録が作成されていなければなりません。
QMS省令は、ISO 13485をもとに作成されています。
ISO 13485は、マネジメント(経営者)の責任・リソース(資源)の配分(Plan)、製品実現(Do)、監視測定(Check)、改善(Action)といったPDCAサイクルで構成されています。
PDCAサイクルがあるということは、品質保証システムがあるということで、「今日」よりも「明日」、「明日」よりも「明後日」の方が品質が向上していくという証明となります。
規制当局は「継続的な改善」を求めています。
日進月歩の医療機器においては、常に設計変更が求められ、品質の改善も求められています。
本講座は16講(2時間/講)にわたって、医療機器業界にけるQMSに関する規制要件の内容を初心者にとって分かりやすく、丁寧に解説いたします。”]
[blogcard url=”https://ecompliance.co.jp/SHOP/QMS-MHLW-00.html” title=”【2021年度改正QMS省令対応】QMSひな形一式” content=”厚生労働省は、2021年3月26日付で「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令の一部を改正する省令」(令和3年厚生労働省令第60号)を公布しました。
経過措置期間は 3年間であり、2024年3月26日(改正省令の施行の日から起算して3年を経過する日)には新QMS省令を遵守しなければなりません。
今回の改正の趣旨は、QMS省令と医療機器の品質マネジメントシステムの国際規格であるISO13485:2016と整合を図ることです。
改正前のQMS省令はISO13485:2003年版と整合させており、最新の国際規格からは遅れていました。
厚生労働省は、2021年3月26日付で新QMS省令に関する逐条解説も公表しています。 「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令の一部改正について」(薬生発0326第10 号)
イーコンプライアンスでは、下記のお役立ち資料を作成し配布しております。
・改正QMS省令(本文)
・改正QMS省令と現行のQMS省令の対比表
・改正QMS省令逐条解説
・品質マニュアル(QMS省令2021年版対応)
・改正QMS省令手順化要求差異配布
・製品標準書新旧対応表配布
ご希望の方はこちらからダウンロードをお願いいたします。
すでに現行QMS省令に準拠したQMSを構築されている方で、改正対応が必要な方
これから医療機器に参入する方
にオススメのひな形セットです。”]
[blogcard url=https://xn--2lwu4a.jp/qms-md/ title=”QMS(手順書)ひな形 医療機器関連” ]
I love your blog.. very nice colors & theme. Did you create this website yourself? Plz reply back as I’m looking to create my own blog and would like to know wheere u got this from. thanks
I haven’t checked in here for some time because I thought it was getting boring, but the last several posts are good quality so I guess I will add you back to my daily bloglist. You deserve it my friend 🙂
I dugg some of you post as I thought they were very helpful very helpful
Great wordpress blog here.. It’s hard to find quality writing like yours these days. I really appreciate people like you! take care
Really superb info can be found on site.Raise blog range
Fantastic site. A lot of useful info here. I am sending it to several pals ans also sharing in delicious. And of course, thanks for your sweat!
Merely wanna say that this is invaluable, Thanks for taking your time to write this.
Some really interesting information, well written and broadly speaking user friendly.
Would you be serious about exchanging links?
The next time I read a blog, I hope that it doesnt disappoint me as much as this one. I mean, I know it was my choice to read, but I actually thought youd have something interesting to say. All I hear is a bunch of whining about something that you could fix if you werent too busy looking for attention.
Wow! Thank you! I continually wanted to write on my blog something like that. Can I implement a portion of your post to my blog?
I am glad to be a visitor of this staring blog! , thanks for this rare information! .
Sight Care
Fitspresso review
Cellucare review
Cellucare reviews
Lottery defeater
Sightcare reviews
Fitspresso
Sight Care
Nano defense pro
Fitspresso stands as a scientifically validated weight loss formula intricately crafted from potent ingredients, aimed at enhancing the body’s metabolic functions. Tailored to support the circadian rhythm and ignite the fat-burning process, this supplement is conveniently available in edible pill form for daily consumption.
Fitspresso
Cellu care
Cellu care
Sumatra Slim Belly Tonic reviews
Lottery defeater software
Fitspresso reviews
Fitspresso
Lottery defeater software reviews
Lottery defeater
Opini pix funciona
Opini pix é golpe
Ikaria Lean Belly Juice
Cellucare reviews
Fitspresso review
Fitspresso reviews
Fitspresso review
Fitspresso
Dentavim
Fitspresso
Fitspresso reviews
Fitspresso review
Fitspresso reviews
Fitspresso
Fitspresso
Fitspresso
Juice to loss weight
Rattling wonderful info can be found on web site. “The greatest mistake is trying to be more agreeable than you can be.” by Walter Bagehot.
Great remarkable issues here. I am very glad to peer your article. Thanks so much and i’m having a look forward to touch you. Will you please drop me a mail?
Zencortex reviews
Lottery defeater reviews
Neotonics gummies review
Sight Care reviews
Sight Care reviews
Dentavim
PROVADENT OFFICIAL
Dentavim is a dietary supplement formulated to support oral health and improve dental hygiene. With increasing awareness of the importance of maintaining good oral health, Dentavim has emerged as a popular choice for individuals seeking to enhance their dental care regimen. This article provides a detailed overview of Dentavim, including its ingredients, benefits, potential side effects, and overall effectiveness.
Lottery defeater software
But a smiling visitant here to share the love (:, btw outstanding design.
Nice blog! Is your theme custom made or did you download it from somewhere? A design like yours with a few simple adjustements would really make my blog shine. Please let me know where you got your design. Bless you
Sight Care reviews
Pineal XT reviews
Neotonics reviews
Kerassentials review
Hi, Neat post. There’s a problem with your website in web explorer, would check thisK IE still is the marketplace chief and a large element of people will omit your magnificent writing because of this problem.
sugar defender side effects
Cellucare reviews
Fitspresso review
sugar defender benefits
Fitspresso is a brand-new natural weight loss aid designed to work on the root cause of excess and unexplained weight gain. The supplement uses an advanced blend of vitamins, minerals, and antioxidants to support healthy weight loss by targeting the fat cells’ circadian rhythm
Javaburn reviews
Fitspresso review
Fitspresso reviews
Fitspresso
Fitspresso is a brand-new natural weight loss aid designed to work on the root cause of excess and unexplained weight gain. The supplement uses an advanced blend of vitamins, minerals, and antioxidants to support healthy weight loss by targeting the fat cells’ circadian rhythm
Fitspresso
Fitspresso is a brand-new natural weight loss aid designed to work on the root cause of excess and unexplained weight gain. The supplement uses an advanced blend of vitamins, minerals, and antioxidants to support healthy weight loss by targeting the fat cells’ circadian rhythm
Fitspresso
Java Burn
SUGAR DEFENDER REVIEWS
TONIC GREENS
sugar defender supplement
Lottery defeater software review
Lottery defeater software reviews
Fitspresso review
Fitspresso
Fitspresso review
Sight Care
Cellucare review
Puravive review
Lottery defeater review
Neotonics gummies reviews
Fitspresso reviews
Fitspresso review
LOTTERY DEFEATER SOFTWARE
LOTTERY DEFEATER
Nano defense pro reviews
Puravive
GROWTH MATRIX
Fitspresso review
Neotonics gummies reviews
Lift detox black
provadent review
SYNC SUPPLEMENT
PROVADENT REVIEW
LIPOZEM
LOTTERY DEFEATER REVIEWS
Lottery defeater system review
SUGAR DEFENDER REVIEWS
provadent supplement
The genius wave
LOTTERY DEFEATER SOFTWARE REVIEWS
SightCare
The genius wave system
Lottery defeater reviews
Lottery defeater system reviews
sugar defender supplement
Lottery defeater system review
The genius wave
Dentavim reviews
PROSTAVIVE REVIEWS
PLANTSULIN
Lipo slend reviews
Lipozem review
Puravive reviews
GLUCO FREEDOM REVIEWS
sugar defender
Provadent review
The genius wave
Dentavim review
Cellucare
Billionaire brain wave review
Erecprime review
LIPOZEM
ALPHA BITES REVIEWS
Pronerve
Lottery defeater reviews
ALPHA BITES
Dentavim reviews
Tonic Greens reviews
Pro nerve 6 reviews
Billionaire brain wave reviews
Sumatra Slim Belly Tonic review
Pineal XT review
Provadent review
Lottery defeater reviews
Plantsulin reviews
Liv care Liver support
Flexigenics reviews
Boostaro reviews
Lottery defeater software
Boostaro reviews
Fitspresso review
Sight Care
Lipozem review
The genius wave
ALPHA BITES REVIEW
Purevive reviews
Nanodefense pro reviews
PROSTAVIVE
Lipozem review
PROSTAVIVE REVIEWS
PROSTAVIVE
Boostaro reviews
Fitspresso
Alphabites review
Quietum plus reviews
nitric boost reviews
The genius wave review
Alpha bites
Lipozem reviews
PROVADENT REVIEW
SUGAR DEFENDER REVIEWS
Alphabites
LIPOZEM REVIEW
nitric boost results
Alphabites review
nagano reviews
Plantsulin review
Alphabites review
Lipozem reviews
Lottery defeater reviews
NAGANO TONIC
LOTTERY DEFEATER
ALPHA BITES
Alphabites review
Fitspresso review
Alpha bites
Alphabites reviews
LOTTERY DEFEATER SOFTWARE
BOOSTARO REVIEWS
FITSPRESSO REVIEW
LOTTERY DEFEATER
BOOSTARO
NAGANO TONIC
ALPHA BITES REVIEWS
Lottery defeater system reviews
Lipozem
Fitspresso
Alphabites
TURMERIC HACK
LIPOZEM REVIEW
PURAVIVE REVIEWS
FITSPRESSO
Hey there! Do you know if they make any plugins to protect against hackers? I’m kinda paranoid about losing everything I’ve worked hard on. Any recommendations?
Lipo Slim
Lipo Slim review
NERVOVIVE
You have brought up a very excellent details , regards for the post.
Alpha bites review
FREE SUGAR PRO REVIEW
Alphabites review
Lipozem review
Bariatric tea
Alpha bites review
Bariatric tea
Alpha bites
Alphabites
Femipro review
MANNA FLUX
Kerassentials
Alpha bites reviews
Boostaro review
TONIC GREENS
LEANBIOME REVIEW
Dentavim
SUGAR DEFENDER REVIEW
Booster XT ingredients
buy Booster XT
Alpha bites reviews
Alpha bites review
how does Booster XT work
Booster XT testosterone boost
NEUROQUIET
NEUROQUIET
Alpha bites reviews
Fitspresso review
Mitolyn
Lipozem reviews
Mitolyn review
Mitolyn
MITOLYN
Mitolyn reviews
Mitolyn
Mitolyn
buy Booster XT
Lottery defeater software
Fitspresso reviews
Alphabites
Alpha bites review
Nicoya PuraTea review
Booster XT testosterone boost
Mitolyn reviews
Mitolyn review
Mitolyn review
Mitolyn
Mitolyn
Mitolyn review
Mitolyn
Mitolyn
ALPHA BITES
MITOLYN REVIEWS
ALPHA BITES
Lipozem reviews
PROSTAZEN REVIEW
PROSTAZEN
LIPOZEM REVIEWS
SERENAFLOW REVIEWS
MITOLYN REVIEW
Mitolyn reviews
Mitolyn review
Fitspresso
Fitspresso review
Kerassentials review
MITOLYN REVIWS
TRIBALFORCE
MITOLYN
ALPHA BITES
Mitolyn
Mitolyn
Mitolyn
MITOLYN
Neuroquiet review
Mitolyn
Mitolyn
NEOTONICS REVIEW
SUGAR DEFENDER
Mitolyn review
Mitolyn
PROSTAZEN
PROSTAZEN REVIEWS
Nagano Lean Body Tonic review
Mitolyn
Leanbiome review
TRIBAL FORCE X REVIEW
TONIC GREENS REVIEWS
Mitolyn review
ProvaDent
TRIBAL FORCE X REVIEWS
MITOLYN
Mitolyn review
MITOLYN REVIEW
LeanBiome
LeanBiome review
Mitolyn review
LOTTERY DEFEATER SOFTWARE
LOTTERY DEFEATER SOFTWARE
Mitolyn review
Lottery Defeater review
ALPHA BITES REVIEWS
Mitolyn
PROVADENT
Mitolyn
Mitolyn review
Mitolyn reviews
Mitolyn
Mitolyn reviews
Mitolyn
Mitolyn reviews
Mitolyn
Mitolyn reviews
Mitolyn
MITOLYN REVIEW
MITOLYN
MITOLYN REVIEW
MITOLYN
MITOLYN REVIEWS
MITOLYN
Boostaro review
ERECPRIME REVIEW
Mitolyn
Tonic greens review
Tonic greens review
Quietum plus review
Nagano Lean Body Tonic
Nagano Lean Body Tonic
Nagano Lean Body Tonic Review
Mitolyn review
LOTTERY DEFEATER
ALPHA BITES
AIZEN POWER
LOTTERY DEFEATER REVIEWS
LOTTERY DEFEATER
AIZEN POWER REVIEWS
MITOLYN
MITOLYN
MITOLYN REVIEW
LOTTERY DEFEATER REVIEWS
DENTICORE REVIEWS
DENTICORE REVIEWS
PROSTAVIVE REVIEWS
PROSTAVIVE REVIEWS
TONIC GREENS REVIEWS
MITOLYN REVIEW
Mytolyn review
MITOLYN REVIEW
MITOLYN REVIEWS
MITOLYN
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
Mitolyn review
MITOLYN
MITOLYN REVIEW
MITOLYN
Alpha Bites
MITOLYN
MITOLYN REVIEW
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEW
MITOLYN REVIEWS
MITOLYN
SOULMATE STORY
Lottery Defeater
PRODENTIM
NATURAL MOUNJARO DRINK
Lottery Defeater
MITOLYN
NATURAL MOUNJARO DRINK
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO DRINK
Boostaro review
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO DRINK
NATURAL MOUNJARO DRINK
MITOLYN WEIGHT LOSS
Pronerve6 review
NATURAL MOUNJARO RECIPE
Billionaire Brain Wave Review
NATURAL MOUNJARO RECIPE
MITOLYN
MITOLYN
Billionaire Brain Wave Review
MITOLYN
MITOLYN REVIEW
MITOLYN REVIEWS
MITOLYN
MITOLYN
MITOLYN WEIGHT LOSS
MITOLYN REVIEW
MITOLYN REVIEW
Mitolyn
MITOLYN
MITOLYN REVIEW
Kerassentials
MITOLYN REVIEW
PRODENTIM REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
Boostaro review
MITOLYN REVIEWS
MITOLYN REVIEWS
Lottery Defeater Software
MITOLYN
NATURAL MOUNJARO RECIPE
MITOLYN REVIEWS
SUGAR DEFENDER
MITOLYN REVIEWS
Leanbiome
NATURAL MOUNJARO RECIPE
NAGANO TONIC REVIEWS
Mitolyn
MITOLYN REVIEWS
PRODENTIM REVIEWS
NAGANO TONIC
PRODENTIM REVIEWS
PRODENTIM REVIEW
PRODENTIM REVIEWS
NAGANO TONIC
NAGANO LEAN BODY TONIC
MITOLYN REVIEW
MITOLYN REVIEWS
NAGANO LEAN BODY TONIC
PRODENTIM REVIEW
NATURAL MOUNJARO
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE
POTENTSTREAM
NATURAL MOUNJARO
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO
POTENT STREAM
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO
NATURAL MOUNJARO
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE
POTENT STREAM
NATURAL MOUNJARO
NATURAL MOUNJARO
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
POTENT STREAM REVIEWS
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
POTENT STREAM REVIEWS
NATURAL MOUNJARO RECIPE
MITOLYN REVIEW
MITOLYN REVIEWS
PROSTAZEN REVIEW
MITOLYN REVIEW
MITOLYN REVIEWS
PROSTAZEN REVIEWS
MITOLYN
MITOLYN REVIEWS
PROSTAZEN REVIEWS
MITOLYN REVIEW
MITOLYN REVIEWS
PROSTAZEN REVIEW
MITOLYN REVIEW
NATURAL MOUNJARO RECIPE
PROSTAZEN REVIEWS
NATURAL MOUNJARO
NATURAL MOUNJARO
PROSTAZEN
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO
PROSTAZEN
NATURAL MOUNJARO
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
Herpafend review
MITOLYN REVIEW
MITOLYN REVIEWS
Mitolyn
NITRIC BOOST
MITOLYN REVIEW
MITOLYN
NERVE FRESH REVIEW
MITOLYN
MITOLYN REVIEW
NERVE FRESH REVIEW
MITOLYN REVIEW
MITOLYN REVIEW
NERVE FRESH REVIEWS
MITOLYN
Java burn
MITOLYN REVIEW
NERVE FRESH REVIEWS
MITOLYN REVIEWS
Mitolyn
MITOLYN
NATURAL MOUNJARO
Mitolyn
MITOLYN REVIEWS
MITOLYN
Tea burn review
MITOLYN REVIEWS
KERASSENTIALS REVIEWS
MITOLYN
MITOLYN REVIEWS
MITOLYN
MITOLYN REVIEWS
MITOLYN
MITOLIN REVIEWS
MITOLYN REVIEW
MITOLYN
KERASSENTIALS
MITOLYN
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN IN BED
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN IN BED
SALT TRICK
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK FOR MEN IN BED
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
Thank you ever so for you post.Much thanks again. Fantastic.
SALT TRICK FOR MEN
SALT TRICK FOR MEN
ALPHA BITES
ALPHA BITES
Mitolyn review
FITSPRESSO REVIEW
ALPHA BITES REVIEWS
ALPHA BITES REVIEW
ALPHA BITES REVIEW
Sight Care review
FITSPRESSO
ALPHA BITES REVIEWS
ALPHA BITES
Lottery Defeater
FITSPRESSO
NATURAL MOUNJARO
Leanbiome review
NATURAL MOUNJARO RECIPE 4 INGREDIENTS
SALT TRICK FOR MEN IN BED
MITOLYN REVIEWS
MITOLYN REVIEW
NATURAL MOUNJARO
Leanbiome review
Mitolyn
Mitolyn review
Mitolyn
Lottery Defeater
Lottery Defeater
Herpafend
Herpafend review
Prodentim review
wow, awesome article post. Really Cool.
Prodentim
Prodentim
SALT TRICK RECIPE
SALT TRICK RECIPE
SALT TRICK FOR MEN
LOTTERY DEFEATER
LOTTERY DEFEATER SOFTWARE
SALT TRICK
SALT TRICK RECIPE
SALT TRICK RECIPE
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK RECIPE
SALT TRICK
SALT TRICK FOR MEN
NITRIC BOOST ULTRA
Boostaro review
NITRIC BOOST ULTRA REVIEWS
NITRIC BOOST
NITRIC BOOST ULTRA
NITRIC BOOST
Thanks for sharing, this is a fantastic post.Thanks Again.
Lottery defeater review
MITOLYN
MITOLYN
MITOLYN
Lottery defeater review
MITOLYN
Major thanks for the article. Fantastic.
NITRIC BOOST
NITRIC BOOST ULTRA
NITRIC BOOST ULTRA
Leanbiome
NITRIC BOOST ULTRA
NITRIC BOOST ULTRA
NITRIC BOOST ULTRA REVIEWS
NITRIC BOOST ULTRA
NITRIC BOOST
NITRIC BOOST
NITRIC BOOST ULTRA REVIEWS
My brother suggested I would possibly like this blog.He used to be entirely right. This put up truly made my day.You cann’t imagine simply how so much time I had spent for this information! Thanks!
NITRIC BOOST
MITOLYN
NATURAL MOUNJARO RECIPE
MITOLYN REVIEW
NATURAL MOUNJARO RECIPE
MITOLYN REVIEWS
MITOLYN
NATURAL MOUNJARO
MITOLYN REVIEW
NATURAL MOUNJARO
NATURAL MOUNJARO TEA
MITOLYN REVIEW
SALT TRICK FOR MEN
SALT TRICK FOR MEN
MITOLYN REVIEW
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN REVIEWS
MITOLYN
MITOLYN
MITOLYN REVIEWS
Quietum Plus
MITOLYN
ZenCortex review
Quietum Plus review
Moundrops reviews
Tonic Greens
Moundrops reviews
Provadent review
Mitolyn reviews
TonicGreens
Mitolyn review
Tonic Greens
Mounjaro recipe
Tonic Greens review
Natural mounjaro recipe
Natural mounjaro
SALT TRICK
Salt trick for man growth
SALT TRICK RECIPE
SALT TRICK RECIPE
SALT TRICK RECIPE
Salt trick for men in bed
Salt trick to stay hard
Salt trick for man growth
Salt trick for man growth
SALT TRICK RECIPE
SALT TRICK FOR MEN
Salt trick explained
MITOLYN REVIEWS
MITOLYN
MITOLYN REVIEWS
MITOLYN
SALT TRICK
nitric boost ingredients
SALT TRICK FOR ED
SALT TRICK FOR ED
ultra boost
SALT TRICK FOR ED
SALT TRICK FOR MEN
nitric boost ingredients
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR ED
TURMERIC HACK
TURMERIC HACK FOR WEIGHT LOSS
TURMERIC HACK RECIPE
Mitolyn reviews
TURMERIC HACK
Mitolyn review
nitric boost ultra
SALT TRICK FOR MEN IN BED
Lottery Defeater
VERTIGENICS REVIEWS
SALT TRICK
Lean Body Tonic
SALT TRICK FOR MEN
Salt trick recipe
SALT TRICK
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN
GlucoPure review
SALT TRICK FOR MEN
NITRIC BOOST ULTRA
NITRIC BOOST
Natural mounjaro
Looking forward to reading more. Great blog article.Much thanks again. Fantastic.
SALT TRICK FOR MEN
SALT TRICK FOR MEN
Neuroquiet review
SALT TRICK
MEMOFORCE REVIEWS
NITRIC BOOST
Salt trick for man growth
BLUE SALT TRICK
MEMOFORCE
SALT TRICK
NITRIC BOOST ULTRA
MEMOFORCE REVIEWS
SALT TRICK FOR MEN IN BED
SALT TRICK
Mitolyn review
MITOLYN REVIEWS
Neuroquiet
MITOLYN REVIEW
MITOLYN REVIEW
MITOLYN REVIEW
ICE WATER HACK
ICE HACK
ICE WATER HACK
Ozenvitta valor
ICE WATER DIET
ICE HACK
BLUE SALT TRICK
Java Burn
SALT TRICK FOR MEN
Salt Trick
BLUE SALT TRICK
SALT TRICK FOR MEN
nitric boost ultra review
SALT TRICK FOR MEN
NATURAL MOUNJARO RECIPE
SALT TRICK
nitric boost ultra
Salt Trick
SALT TRICK FOR MEN
BLUE SALT TRICK
Salt trick for men in bed
SALT TRICK FOR MEN
SALT TRICK FOR MEN
BLUE SALT TRICK
SALT TRICK FOR MEN
nitric boost ultra review
SALT TRICK
Mitolyn
SALT TRICK FOR MEN VIDEO
Salt trick for men in bed
SALT TRICK TO STAY HARD
nitric boost ultra
BLUE SALT TRICK FOR MEN IN BED
Leanbiome
SALT TRICK TUTORIAL
salt trick for men wrestling best
SALT TRICK TUTORIAL
BLUE SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN IN BED
ProDentim
SALT TRICK FOR MEN
SALT TRICK TUTORIAL
Boostaro
BRAZILIAN NATURAL MOUNJARO RECIPE
Boostaro review
BRAZILIAN MOUNJARO WEIGHT LOSS
BRAZILIAN MOUNJARO RECIPE
THE MONEY WAVE
BRAZILIAN MOUNJARO RECIPE
BRAZILIAN MOUNJARO DIET
BRAZILIAN MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
Lottery defeater
BRAZILIAN MOUNJARO DRINK
Nervefresh
BRAZILIAN MOUNJARO DRINK
SALT TRICK
Leanbiome
NATURAL MOUNJARO
ICE WATER HACK
Mitolyn
BLUE SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
BLUE SALT TRICK
ICE WATER HACK DIET
SALT TRICK FOR MEN
SALT TRICK
ICE WATER HACK DIET
BLUE SALT TRICK
ICE WATER HACK
BLUE SALT TRICK
ICE WATER HACK TRICK
ICE WATER HACK
ICE WATER HACK
BLUE SALT TRICK
SALT TRICK
NATURAL MOUNJARO RECIPE
BLUE SALT TRICK
Zencortex
BLUE SALT TRICK
BLUE SALT TRICK
BLUE SALT TRICK
SALT TRICK
NATURAL MOUNJARO
BLUE SALT TRICK
BLUE SALT TRICK
Zencortex
BLUE SALT TRICK
BLUE SALT TRICK
SALT TRICK FOR MEN
BLUE SALT TRICK
Zencortex review
SALT TRICK FOR MEN
BLUE SALT TRICK
Sight care
SALT TRICK
SALT TRICK
Ice Water Hack for Weight Loss
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
ICE WATER HACK
BLUE SALT TRICK
Great post. I was checking continuously this blog and I’m impressed!Very helpful info specifically the last part 🙂 I care for such info much.I was looking for this particular information for a long time.Thank you and best of luck.
SALT TRICK
ICE WATER HACK
Sight care review
NANODEFENSE PRO
NANODEFENSE PRO
NATURAL MOUNJARO
Natural Mounjaro
BLUE SALT TRICK
SALT TRICK FOR MEN
SALT TRICK
NATURAL MOUNJARO
https://www.youtube.com/watch?v=A3RESE9jE90
Tonic Greens
SALT TRICK FOR MEN IN BED
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK FOR MEN
MITOLYN REVIEW
MITOLYN
Sight care review
SALT TRICK
NATURAL MOUNJARO
MITOLYN REVIEWS
NATURAL MOUNJARO
Prodentim
SALT TRICK FOR MEN
NATURAL MOUNJARO
MITOLYN REVIEWS
Lottery Defeater
NATURAL MOUNJARO
ICE WATER HACK
ICE WATER HACK FOR WEIGHT LOSS
SALT TRICK
NATURAL MOUNJARO
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
TURMERIC TRICK
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
BLUE SALT TRICK
SALT TRICK
BLUE SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
Mitolyn
NATURAL MOUNJARO
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
ICE WATER HACK WEIGHT LOSS
SALT TRICK
ICE WATER HACK
SALT TRICK FOR MEN
ICE WATER HACK WEIGHT LOSS
SALT TRICK FOR MEN
Tonic Greens
SALT TRICK
ICE HACK DIET
ICE WATER HACK
SALT TRICK
SALT TRICK
ICE WATER HACK
ICE HACK RECIPE
SALT TRICK
SALT TRICK
SALT TRICK
Sight care
LOTTO CHAMP REVIEWS
SALT TRICK FOR MEN
LOTTOCHAMP
SALT TRICK FOR MEN
SALT TRICK FOR MEN
LOTTOCHAMP
Sight care
Tonic Greens review
Mitolyn
Lottery defeater review
Lottery defeater
Boostaro
SALT TRICK FOR MEN
TURMERIC HACK RECIPE
SALT TRICK FOR MEN
TURMERIC HACK FOR WEIGHT LOSS
Natural Mounjaro recipe
Natural Mounjaro
TURMERIC HACK TO WEIGHT LOSS
TURMERIC HACK RECIPE
TURMERIC HACK
COFFEE LOOPHOLE RECIPE
Sight care review
Java Burn
SALT TRICK FOR MEN
Prodentim
SALT TRICK
Prodentim review
Leanbiome
Leanbiome
Prodentim
Zencortex
Boostaro
Sight care review
NATURAL MOUNJARO RECIPE
Sight care review
LOTTERY DEFEATER SOFTWARE
Nagano Lean Body Tonic
SALT TRICK FOR MEN
SALT TRICK FOR MEN
SALT TRICK
SALT TRICK
NATURAL MOUNJARO
SALT TRICK
SALT TRICK FOR MEN
Lottery Defeater
NeuroQuiet review
Thanks for the post.Thanks Again. Really Great.
Quietum Plus review
Sight care
Prodentim review
Prodentim review
MITOLYN REVIEWS
SALT TRICK
I cannot thank you enough for the article post.Really thank you! Great.
SALT TRICK FOR MEN
SALT TRICK FOR MEN
BRAZILIAN MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
Leanbiome review
Aqua Sculpt
LIPOZEM REVIEW
SALT TRICK
ICE WATER HACK
SALT TRICK FOR MEN
LIPOZEM REVIEW
LIPOZEM REVIEWS
Aqua Sculpt
Lottochamp
ICE WATER HACK RECIPE
ICE WATER HACK FOR WEIGHT LOSS
ICE WATER HACK
SALT TRICK FOR MEN
BLUE SALT TRICK
Major thanks for the blog.Thanks Again. Keep writing.
Prostazen review
BLUE SALT TRICK
SALT TRICK FOR MEN
SALT TRICK FOR MEN
WHISPEARA
SALT TRICK
Gluco Extend
Prime Biome
NATURAL MOUNJARO RECIPE
Gluco Tonic
Gluco Tonic
Sight care
I appreciate you sharing this blog article.Thanks Again. Really Cool.
Vertigenics
Appanail
Prodentim review
SALT TRICK
SALT TRICK
Zencortex
SALT TRICK FOR MEN
BRAZILIAN MOUNJARO RECIPE
BRAZILIAN MOUNJARO RECIPE
https://www.youtube.com/watch?v=7IWocKZbVq0
SALT TRICK
Denticore
Nerve fresh review
Moringa magic
PRODENTIM
THE GROWTH MATRIX
Salt trick for man growth
Salt trick for man
Boostaro review
Salt trick for men
Lottery defeater review
Salt trick for man growth
Awesome blog article.Really thank you! Fantastic.
ICE WATER HACK
Prodentim review
Ice water hack diet
Prodentim review
ICE WATER HACK FOR WEIGHT LOSS
MITOLYN REVIEW
MITOLYN REVIEWS
ICE WATER HACK FOR WEIGHT LOSS
Gluco6
Nitric Boost
Nitric boost ultra reviews
Nitric boost ultra reviews
ICE WATER HACK
Salt trick for men
Prodentim
BLACK WOOD TEA
Quietum plus review
primebiome review
primebiome reviews
primebiome review
I value the blog article. Want more.
primebiome
LeanBiome review
BRAZILIAN MOUNJARO
Im thankful for the article.Really looking forward to read more. Cool.
Prodentim review
Natural mounjaro
PRIME BIOME REVIEW
Brazilian natural mounjaro
PINK SALT TRICK RECIPE
Prodentim
Natural mounjaro recipe
Prodentim
Lottochamp
Natural mounjaro recipe
BRAZILIAN MOUJARO RECIPE
Natural mounjaro recipe
Brazilian natural mounjaro
Mitolyn
Lottochamp
NATURAL MOUNJARO
Natural mounjaro
Lotto Champ review
Mitolyn review
Natural mounjaro recipe
MITOLYN
Tonic Greens review
Natural Mounjaro
Natural Mounjaro
BLUE SALT TRICK
Very neat blog. Much obliged.
BRAZILIAN MOUNJARO RECIPE
Great blog.Really thank you! Want more.
The design and usability are top-notch, making everything flow smoothly.
PRODENTIM REVIEW
The design and usability are top-notch, making everything flow smoothly.
I’m really impressed by the speed and responsiveness.
I love how user-friendly and intuitive everything feels.
Very neat blog.Thanks Again. Really Great.
The content is engaging and well-structured, keeping visitors interested.
I value the blog post.Really looking forward to read more. Fantastic.
Major thankies for the blog article.Thanks Again. Really Great.
The content is well-organized and highly informative.
Very neat blog article.Much thanks again. Will read on…
The content is engaging and well-structured, keeping visitors interested.
A perfect blend of aesthetics and functionality makes browsing a pleasure.
I value the blog post.Much thanks again. Awesome.
I love how user-friendly and intuitive everything feels.
I’m really impressed by the speed and responsiveness.
The content is engaging and well-structured, keeping visitors interested.
The content is engaging and well-structured, keeping visitors interested.
This site truly stands out as a great example of quality web design and performance.
Muchos Gracias for your article post.Really looking forward to read more. Will read on…
The content is engaging and well-structured, keeping visitors interested.
The design and usability are top-notch, making everything flow smoothly.
The content is well-organized and highly informative.
Nothing beats homemade pasta. The texture and flavor are just on another level compared to store-bought versions. Cooking from scratch is truly an art.
Consistency is key in fitness. You won’t see results overnight, but every workout counts. The small efforts add up over time and create real change.
Live concerts have a special magic. No recording can ever capture that raw energy of the crowd and the artist performing in the moment.
Watching a sunset over the ocean is one of the most peaceful experiences in life. Nature has a way of reminding us how small but connected we all are.
I value the post.Really thank you! Cool.
Thanks-a-mundo for the article. Keep writing.
Really informative blog.Much thanks again. Really Cool.
Muchos Gracias for your post.Really looking forward to read more. Keep writing.
I appreciate you sharing this post.Really thank you! Great.
All knowledge, it is said, comes from experience, but does that not mean that the more we experience, the wiser we become? If wisdom is the understanding of life, then should we not chase every experience we can, taste every flavor, walk every path, and embrace every feeling? Perhaps the greatest tragedy is to live cautiously, never fully opening oneself to the richness of being.
Man is said to seek happiness above all else, but what if true happiness comes only when we stop searching for it? It is like trying to catch the wind with our hands—the harder we try, the more it slips through our fingers. Perhaps happiness is not a destination but a state of allowing, of surrendering to the present and realizing that we already have everything we need.
The cosmos is said to be an ordered place, ruled by laws and principles, yet within that order exists chaos, unpredictability, and the unexpected. Perhaps true balance is not about eliminating chaos but embracing it, learning to see the beauty in disorder, the harmony within the unpredictable. Maybe to truly understand the universe, we must stop trying to control it and simply become one with its rhythm.
The potential within all things is a mystery that fascinates me endlessly. A tiny seed already contains within it the entire blueprint of a towering tree, waiting for the right moment to emerge. Does the seed know what it will become? Do we? Or are we all simply waiting for the right conditions to awaken into what we have always been destined to be?
Virtue, they say, lies in the middle, but who among us can truly say where the middle is? Is it a fixed point, or does it shift with time, perception, and context? Perhaps the middle is not a place but a way of moving, a constant balancing act between excess and deficiency. Maybe to be virtuous is not to reach the middle but to dance around it with grace.
Virtue, they say, lies in the middle, but who among us can truly say where the middle is? Is it a fixed point, or does it shift with time, perception, and context? Perhaps the middle is not a place but a way of moving, a constant balancing act between excess and deficiency. Maybe to be virtuous is not to reach the middle but to dance around it with grace.
The cosmos is said to be an ordered place, ruled by laws and principles, yet within that order exists chaos, unpredictability, and the unexpected. Perhaps true balance is not about eliminating chaos but embracing it, learning to see the beauty in disorder, the harmony within the unpredictable. Maybe to truly understand the universe, we must stop trying to control it and simply become one with its rhythm.
The potential within all things is a mystery that fascinates me endlessly. A tiny seed already contains within it the entire blueprint of a towering tree, waiting for the right moment to emerge. Does the seed know what it will become? Do we? Or are we all simply waiting for the right conditions to awaken into what we have always been destined to be?
Thanks a lot for the blog. Really Great.
The essence of existence is like smoke, always shifting, always changing, yet somehow always present. It moves with the wind of thought, expanding and contracting, never quite settling but never truly disappearing. Perhaps to exist is simply to flow, to let oneself be carried by the great current of being without resistance.
If everything in this universe has a cause, then surely the cause of my hunger must be the divine order of things aligning to guide me toward the ultimate pleasure of a well-timed meal. Could it be that desire itself is a cosmic signal, a way for nature to communicate with us, pushing us toward the fulfillment of our potential? Perhaps the true philosopher is not the one who ignores his desires, but the one who understands their deeper meaning.
Thanks a lot for the blog post.Much thanks again. Really Cool.
Thanks a lot for the article post. Really Great.
Very good blog post.Thanks Again. Much obliged.
Lottochamp
Prodentim
Appanail review
SALT TRICK FOR MEN
Prime biome
Appanail review
SALT TRICK FOR MAN
Jangan berhenti berbagi ya, karena artikel seperti ini sangat dinantikan sama komunitas pecinta slot kayak saya.
WHISPEARA REVIEW
slot deposit pulsa tanpa potongan – Sekali lagi, makasih banyak buat penulis yang udah ngasih artikel sekeren ini. Jangan berhenti berbagi ya, karena artikel seperti ini sangat dinantikan sama komunitas pecinta slot kayak saya. Sukses terus dan semoga makin banyak pemain yang terbantu karena artikel ini!
slot deposit pulsa tanpa potongan – Sekali lagi, makasih banyak buat penulis yang udah ngasih artikel sekeren ini. Jangan berhenti berbagi ya, karena artikel seperti ini sangat dibutuhkan sama komunitas pecinta slot kayak saya. Sukses terus dan semoga makin banyak pemain yang terbantu karena artikel ini!
Herpafend Review
I really liked your blog article. Fantastic.
Prodentim
Prodentim
Leanbiome
Tonic greens review
slot gacor hari ini – Saya pribadi sangat tertarik oleh gaya penyampaian artikel ini. Penjelasannya to the point dan langsung menyasar ke inti pembahasan, bikin makin percaya buat daftar di situs slot gacor yang dibahas.
NerveFresh
NATURAL MOUNJARO RECIPE
NATURAL MOUNJARO RECIPE
The cosmos is said to be an ordered place, ruled by laws and principles, yet within that order exists chaos, unpredictability, and the unexpected. Perhaps true balance is not about eliminating chaos but embracing it, learning to see the beauty in disorder, the harmony within the unpredictable. Maybe to truly understand the universe, we must stop trying to control it and simply become one with its rhythm.
Gluco Tonic
Gluco Tonic review
ELEPHANT ROOT TRICK
Prodentim review
The cosmos is said to be an ordered place, ruled by laws and principles, yet within that order exists chaos, unpredictability, and the unexpected. Perhaps true balance is not about eliminating chaos but embracing it, learning to see the beauty in disorder, the harmony within the unpredictable. Maybe to truly understand the universe, we must stop trying to control it and simply become one with its rhythm.
Zencortez
Prime Biome
Salt Trick review
Quietum plus
Prodentim
I couldn’t resist commenting
Appanail
Say, you got a nice blog. Fantastic.
Slimberine Review
ARIALIEF
Salt trick review
Nitric Boost review
herpafend
NERVE FRESH REVIEW
Boostaro review
Lottery defeater review
Slimjaro
Mitolyn review
Gluco6 review
Major thanks for the blog.Really looking forward to read more. Really Cool.
Beast Force
Gluco control review
Im thankful for the post.Thanks Again. Great.
ELEPHANT ROOT TRICK
I really liked your blog.Really thank you! Will read on…
Neuroquiet
A round of applause for your blog post.Really thank you! Want more.
Provadent review
Say, you got a nice article post.Thanks Again. Keep writing.
slot gacor – Postingan ini benar-benar menginspirasi dan mampu menambah pengetahuan seputar dunia judi slot digital yang sedang trend. Terima kasih atas pengalaman yang komprehensif, cocok banget untuk penggemar slot seperti saya yang lagi cari slot cuan.
Gumaktiv review
slot gacor – Postingan ini benar-benar bermanfaat dan mampu membuka wawasan seputar dunia slot online yang sedang naik daun. Terima kasih atas pengalaman yang lengkap, cocok banget untuk pencari RTP tinggi seperti saya yang lagi cari slot cuan.
Enjoyed every bit of your article post.Really thank you! Awesome.
Leanbiome
Prostavive
Gluco Extend review
The essence of existence is like smoke, always shifting, always changing, yet somehow always present. It moves with the wind of thought, expanding and contracting, never quite settling but never truly disappearing. Perhaps to exist is simply to flow, to let oneself be carried by the great current of being without resistance.
Beastforce
Lean Body Tonic
Lottery Defeater review
Mitolyn
Glucotrust
Billionaire Brain Ware
Billionaire Brain Ware Review
Kerassentials review
Herpesyl
Fitspresso
Tonic greens review
Dentatonic
Aw, this was a very nice post. Taking the time and actual effort to produce a very good articleÖ but what can I sayÖ I procrastinate a whole lot and don’t manage to get anything done.
Manganese resembles iron in its chemical and physical residential properties, however it is harder and also extra brittle. Manganese is possibly one of the most flexible aspect that can be added to copper alloys.
Wow, great blog post.Really thank you! Really Great.
I am so grateful for your article post.Really thank you! Really Cool.
It?s tough to locate knowledgeable people on this topic, but you seem like you recognize what you?re speaking about! Thanks
We are looking for experienced people that might be interested in from working their home on a full-time basis. If you want to earn $500 a day, and you don’t mind developing some short opinions up, this is the perfect opportunity for you!
A big thank you for your post.Thanks Again. Will read on…
Thanks-a-mundo for the article.Thanks Again. Great.
Hey, thanks for the blog post.Thanks Again. Will read on…
I enjoy looking through an article that will make men and women think. Also, thanks for permitting me to comment!
Great, thanks for sharing this blog. Really Cool.
Is anyone here in a position to recommend Hollow Butt Plugs? Thanks xx
I think this is a real great blog post. Really Cool.
Appreciate you sharing, great blog.Thanks Again.
Thanks again for the blog.Thanks Again. Fantastic.
Thank you ever so for you post.Really looking forward to read more. Great.
Im grateful for the article.Thanks Again.
Very good blog article.Really thank you! Fantastic.
This very blog is no doubt cool and informative. I have chosen many interesting things out of this blog. I ad love to visit it again soon. Thanks a bunch!
Xoilac Tv Thẳng Bóng Đá xem da bong truc tiep k+Đội tuyển chọn futsal nước ta đã được một trận đấu đồng ý được trước đối thủ cạnh tranh đầy mức độ mạnh Lebanon. Kết quả Bà Rịa-Vũng Tàu vs Bình Phước hôm nay 18h00 ngày 5/5, Hạng nhất nước Việt Nam.
Lift detox caps
Wow! This can be one particular of the most beneficial blogs We have ever arrive across on this subject. Actually Excellent. I’m also an expert in this topic therefore I can understand your hard work.
Im thankful for the post.Really thank you! Fantastic.
Hi there, after reading this amazing piece of writing i am as well glad to sharemy experience here with friends.
An interesting discussion is definitely worth comment. I do think that you ought to write more on this topic, it might not be a taboo matter but typically people do not speak about such topics. To the next! All the best!!
Im thankful for the article post.Thanks Again.
ivermectin germany preço do stromectol Opmuhf42 ivermectin generic
Thanks for your marvelous posting! I genuinely enjoyed reading it, you are a great author.I will be sure to bookmark your blog and definitely will come back someday. I want to encourage one to continue your great job, have a nice weekend!
I’m not sure where you are getting your information, but good topic. I needs to spend some time learning more or understanding more. Thanks for great info I was looking for this information for my mission.
I just like the helpful information you provide for your articles. I’ll bookmark your blog and check once more right here regularly. I am reasonably sure I’ll be informed lots of new stuff proper right here! Best of luck for the next!
I really like and appreciate your article post.
I truly appreciate this blog post.Thanks Again. Will read on…
how to write an essayclassification essayhelp writing a essay
Thanks so much for the blog article.Really looking forward to read more.
I don’t even understand how I stopped up here, howeverI believed this post used to be good. I do not understand who you are however definitely you’re going to a well-known bloggerin case you are not already. Cheers!
A big thank you for your blog.Much thanks again. Awesome.
What’s up i am kavin, its my first occasion to commenting anywhere, when i read this post i thought i could also createcomment due to this brilliant piece of writing.
I’ll immediately seize your rss feed as I can’t find your emailsubscription hyperlink or e-newsletter service. Do you have any?Please allow me understand so that I could subscribe. Thanks.
Purdentix
I value the blog article.Really thank you! Really Great.
This is one awesome post. Keep writing.
This is one awesome article post. Keep writing.
Thanks a ton for finding the time to line all of this out for us. This kind of posting has been quite helpful if you ask me.
Im obliged for the article post.Really looking forward to read more. Fantastic.
Wow, great blog article.Much thanks again. Want more.
Awesome article post.Thanks Again. Fantastic.
Fastidious respond in return of this query with genuine arguments and explaining all concerning that.
Really enjoyed this post.Really thank you!
Im obliged for the post.Really thank you! Really Cool.
Im obliged for the post.Really looking forward to read more. Want more.
Very informative blog article.Much thanks again. Will read on…
I think this is a real great blog post.Much thanks again. Want more.
Thank you ever so for you blog post.Really thank you!
Enjoyed every bit of your article post.Really thank you! Much obliged.
Thank you ever so for you post.Really thank you! Keep writing.
Im obliged for the article post.Much thanks again. Keep writing.
Im obliged for the blog article.Really looking forward to read more. Will read on…
I cannot thank you enough for the blog article.Really thank you! Will read on…
Thank you for your post.Really thank you! Will read on…
I am so grateful for your article. Really Cool.
Really enjoyed this article post.Really looking forward to read more. Great.
I truly appreciate this blog article. Keep writing.
Im thankful for the blog post.Thanks Again. Great.
Great, thanks for sharing this article post.Really thank you! Much obliged.
Highly descriptive blog, I enjoyed that a lot.Will there be a part 2?
Im obliged for the post.Thanks Again. Awesome.
Muchos Gracias for your blog post. Keep writing.
I appreciate you sharing this blog post. Really Great.
Appreciate you sharing, great article post.Really looking forward to read more. Much obliged.
Wow, great blog article. Really Great.
This is one awesome article.Much thanks again. Cool.
Really informative post.Much thanks again. Want more.
I truly appreciate this article post.Really thank you!
Great, thanks for sharing this article post.Much thanks again. Awesome.
PINK SALT TRICK FOR WEIGHT LOSS
Im grateful for the blog article. Much obliged.
Very informative post.Much thanks again. Great.
Enjoyed every bit of your post. Really Great.
I am so grateful for your post.Thanks Again. Will read on…
Im obliged for the blog.Much thanks again. Really Great.
Thanks-a-mundo for the blog post. Will read on…
Very good article post.Thanks Again. Want more.
A big thank you for your blog article.Thanks Again. Keep writing.
Thanks so much for the blog post.Really looking forward to read more. Much obliged.
Looking forward to reading more. Great post.Thanks Again. Keep writing.
Thanks-a-mundo for the article.Really thank you! Really Cool.
I cannot thank you enough for the article.Really looking forward to read more. Much obliged.
I appreciate you sharing this article.Thanks Again. Keep writing.
Enjoyed every bit of your blog article.Really thank you! Really Cool.
Your style is very unique compared to other people I have read stuff from. Thanks for posting when you’ve got the opportunity, Guess I will just book mark this blog.
I am so grateful for your post. Will read on…
Great, thanks for sharing this post.Much thanks again. Want more.
Im thankful for the blog.Really thank you!
Really appreciate you sharing this post.Much thanks again. Really Great.
Really appreciate you sharing this blog post. Really Cool.
I appreciate you sharing this article.Much thanks again. Keep writing.
Thanks a lot for the blog article.Thanks Again. Really Cool.
Thanks a lot for the blog.Really thank you! Really Great.
Wow, great article post.Thanks Again. Fantastic.
Really informative blog article. Want more.
Thanks-a-mundo for the article.Really thank you! Keep writing.
I really enjoy the article. Much obliged.
I really liked your article post.Thanks Again.
Major thanks for the article.Really thank you!
Im thankful for the blog article.Really thank you! Really Great.
Very good post. Want more.
Really informative blog.Thanks Again. Great.
Very neat article.Really thank you!
Hey there! I’m at work surfing around your blog from my new apple iphone!Just wanted to say I love reading your blog and look forward to all yourposts! Keep up the superb work!
I value the article post.Really looking forward to read more. Cool.
I really liked your blog post.Really looking forward to read more. Will read on…
I truly appreciate this article post.Much thanks again. Great.
Muchos Gracias for your blog. Will read on…
Fantastic article.Thanks Again. Fantastic.
Muchos Gracias for your article post.Much thanks again. Awesome.
I really like and appreciate your post.Really thank you! Want more.
Appreciate you sharing, great blog post.Really thank you! Really Cool.
wow, awesome article. Fantastic.
Really informative post.Really thank you! Fantastic.
Thanks for the article post.Really looking forward to read more. Really Cool.
Muchos Gracias for your article. Much obliged.
A fascinating discussion is worth comment. I think that you need to publish more on this topic, it might not be a taboo subject but usually folks don’t discuss these issues. To the next! Cheers!!
Looking forward to reading more. Great article. Want more.
Thanks for sharing, this is a fantastic blog post. Great.
Hi there, constantly i used to check blog posts here early in the morning, because i enjoy to learn more and more.
Thank you ever so for you blog article.Really thank you! Really Great.
I am not certain where you’re getting your info, but good topic. I needs to spend some time studying more or figuring out more. Thank you for wonderful info I was in search of this information for my mission.
Really informative article post.Really thank you! Really Great.
Wow, great article.Much thanks again. Fantastic.
I think this is a real great blog.Really looking forward to read more. Really Great.
I really enjoy the article post.Thanks Again. Will read on…
Thanks so much for the blog article.Thanks Again. Really Cool.
There’s certainly a lot to know about this topic. I really like all the points you made.
I think this is a real great blog.Really thank you! Much obliged.
Great, thanks for sharing this blog post.Really thank you!
I really like and appreciate your post. Keep writing.
Looking forward to reading more. Great blog.Much thanks again. Want more.
Very informative blog post.Thanks Again. Really Cool.
Wow, great post.Much thanks again. Really Cool.Loading…
Your method of describing the whole thing in this paragraph is genuinely nice,all be capable of effortlessly understand it, Thanks a lot.
Do you have any video of that? I’d love to findout more details.
These are genuinely enormous ideas in concerning blogging. You have touched some nice things here. Any way keep up wrinting.
I loved your article.Much thanks again. Cool.
Thanks for one’s marvelous posting! I genuinely enjoyed reading it, you can be a great author.Iwill be sure to bookmark your blog and will come back later on.I want to encourage you to continue your great work,have a nice weekend!
Remarkable! Its really awesome paragraph, I have got much clear ideaon the topic of from this post.
wow, awesome article. Much obliged.
Ulasan yang terperinci membuat saya semakin paham topik yang dibahas. Saya merasa sangat dibantu dengan isi yang Anda sajikan ini.
That is really attention-grabbing, You’re an overly skilled blogger. I have joined your feed and stay up for in the hunt for more of your magnificent post. Also, I’ve shared your website in my social networks!
Really enjoyed this post.Thanks Again. Awesome.
Thank you ever so for you article post.Really thank you! Will read on…
Very good blog. Fantastic.
Hello.This post was really remarkable, especially since I was searching for thoughts on this topic last couple of days.
Thank you for your blog post.Really looking forward to read more.
A fascinating discussion is worth comment. There’s no doubt that that you ought to write more on this topic, it might not be a taboo subject but usually people don’t speak about such issues. To the next! Cheers!!
Thanks a lot for the post.Thanks Again. Great.
Very neat blog.Thanks Again.
A round of applause for your blog article.Much thanks again. Really Cool.
Really enjoyed this blog article.Much thanks again. Will read on…
Great, thanks for sharing this article post.Really thank you! Will read on…
Hey, thanks for the blog. Cool.
Great, thanks for sharing this article. Cool.
Fantastic article. Really Cool.
Say, you got a nice blog article. Much obliged.
Muchos Gracias for your article.Really thank you! Want more.