コンピュータ化システムの4つの種類
コンピュータ化システムは、大きく分類して4種類のカテゴリに分けられる。(図1参照)
1) プロセスコントロール(構造設備)
2) ITアプリケーション
3) ラボ(分析機器、Excel)
4) インフラストラクチャ
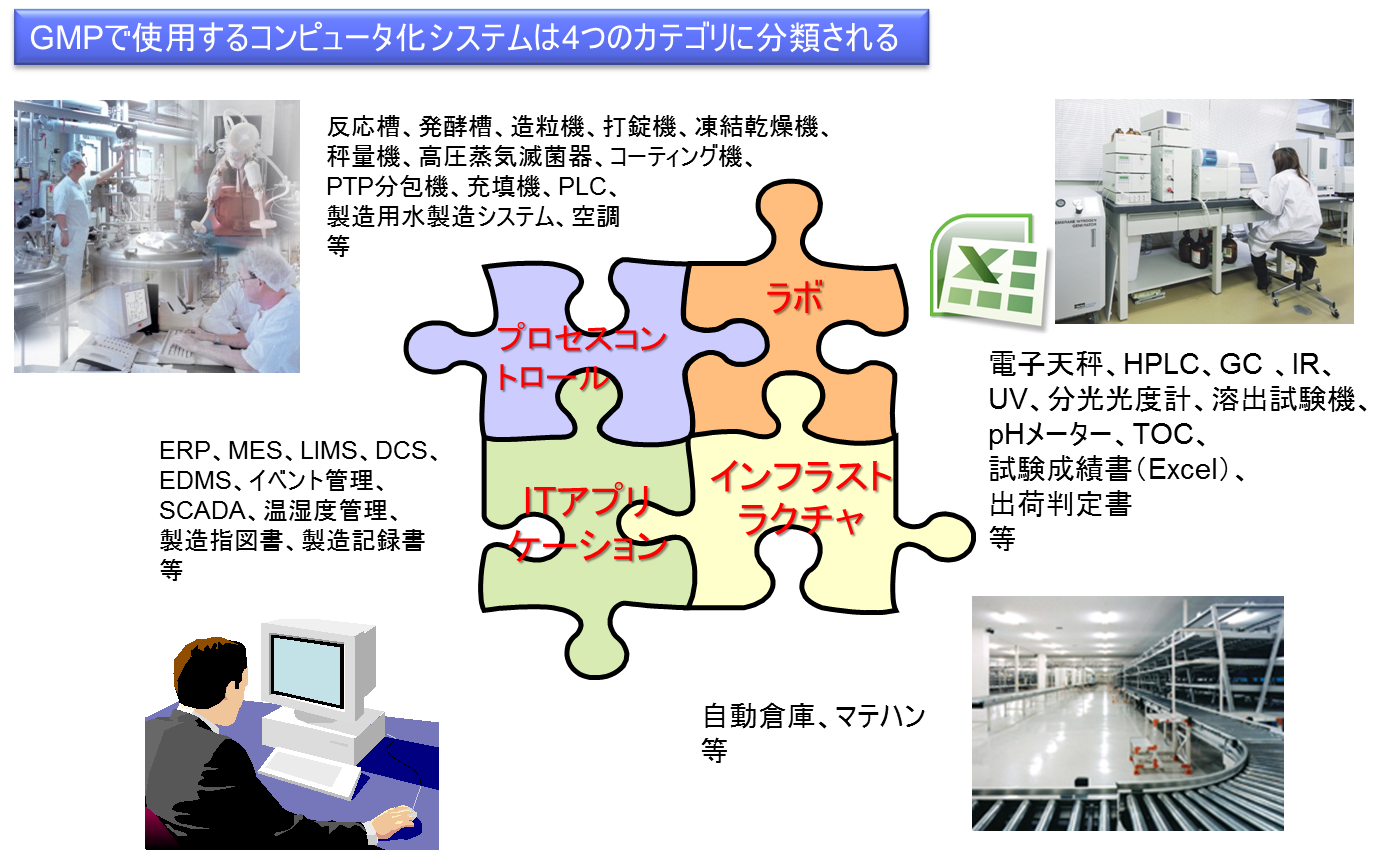
一般に、GMP関連業務においては、上記の4システムがすべて使用される。それに対して、GLP関連業務では、主にラボとITアプリケーションが使用され、GCP・GVP・GQP関連業務では、ITアプリケーションが使用される。
上記4種類のシステムは、それぞれに特徴が異なり、またバリデーションの実施方法が異なる。しかしながら、どのカテゴリにも精通した専門家はほとんどいないのが現状である。
プロセスコントロール(構造設備)
構造設備は、工場のラインに設置され、実際に原薬や製品(製剤)を生産するシステムである。
例えば、原薬工場における反応槽、発酵槽や、製剤工場における造粒機、打錠機、凍結乾燥機、秤量機、高圧蒸気滅菌器、コーティング機、PTP分包機、充填機などが相当する。
また、製造用水製造システムや空調などの支援設備(ユーティリティシステム)も構造設備に含まれる。
構造設備の品質は、製品の品質に大きく影響する。したがって、バリデーションは重要である。
「原薬GMPのガイドライン」では、プロセスバリデーションを始める前に、重要な装置及び付帯設備の適格性評価を完了することとなっている。
構造設備の特徴は、その品質が直感的に把握できることにある。すなわち、あらかじめ実際に製品を生産し、生産された製品の品質を目視チェックや分析することによって検証ができるのである。
構造設備では、PLC、ファームウェアなどの比較的小さなプログラムで制御していることが多い。
多くの構造設備は、カテゴリ3である。ただし、複雑またはユーザが変更したPLCは、カテゴリ5に分類されるが、カテゴリ3と5の境界は曖昧である。
一般に1つの構造設備は、1つの機能しかもたない。例えば、造粒機は造粒する機能、打錠機は打錠する機能である。したがって、多くの場合、構造設備では、機能仕様書は作成しない。(というよりも作成できない。)
構造設備を対象とするバリデーションを「適格性評価」と呼び、DQ(設計時適格性評価)、IQ(設備据付時適格性評価)、OQ(運転時適格性評価)、PQ(性能適格性評価)から構成される。
適格性評価は、製品品質に直接影響する要因についてのみ、設計段階でDQを、製作・施工段階でIQを、試験・検査・試運転段階でOQとPQを行うことである。
昨今は、SCADAやDCSのように、ネットワーク化され、ITアプリケーションにより中央で集中管理されている構造設備も利用されている。
旧ガイドラインではファームウェアやPLCは対象となっていなかった
平成4年2月21日に厚生省(当時)から発出された、薬監第11号「コンピュータ使用医薬品等製造所適正管理ガイドライン」(以下、旧ガイドライン)の「第2.適用範囲」には、以下の記載があった。
このガイドラインは、医薬品GMPが適用される製造所のうち、次のいずれかに該当するシステムを使用する製造所に適用する。
ただし、使用目的が限定され、そのためのプログラムがハードウェア(コンピュータにより制御される機器及び設備を含む。以下同じ。)の提供業者によって汎用機能として固定され、パラメーターを設定することによって機能が実現されるシステムを除くものとする。
この記述を読むと、旧ガイドラインでは、打錠機などの出来合いの構造設備(カテゴリ3)は除外されていたことがわかる。またファームウェアやPLC なども適用されていなかった。
新ガイドラインでは、カテゴリ3 に分類される構造設備や、それらに搭載されているPLC、ファームウェアも適用対象になったことに留意する必要がある。
図に示すとおり、新ガイドラインの別紙2にカテゴリ分類表が添付されている。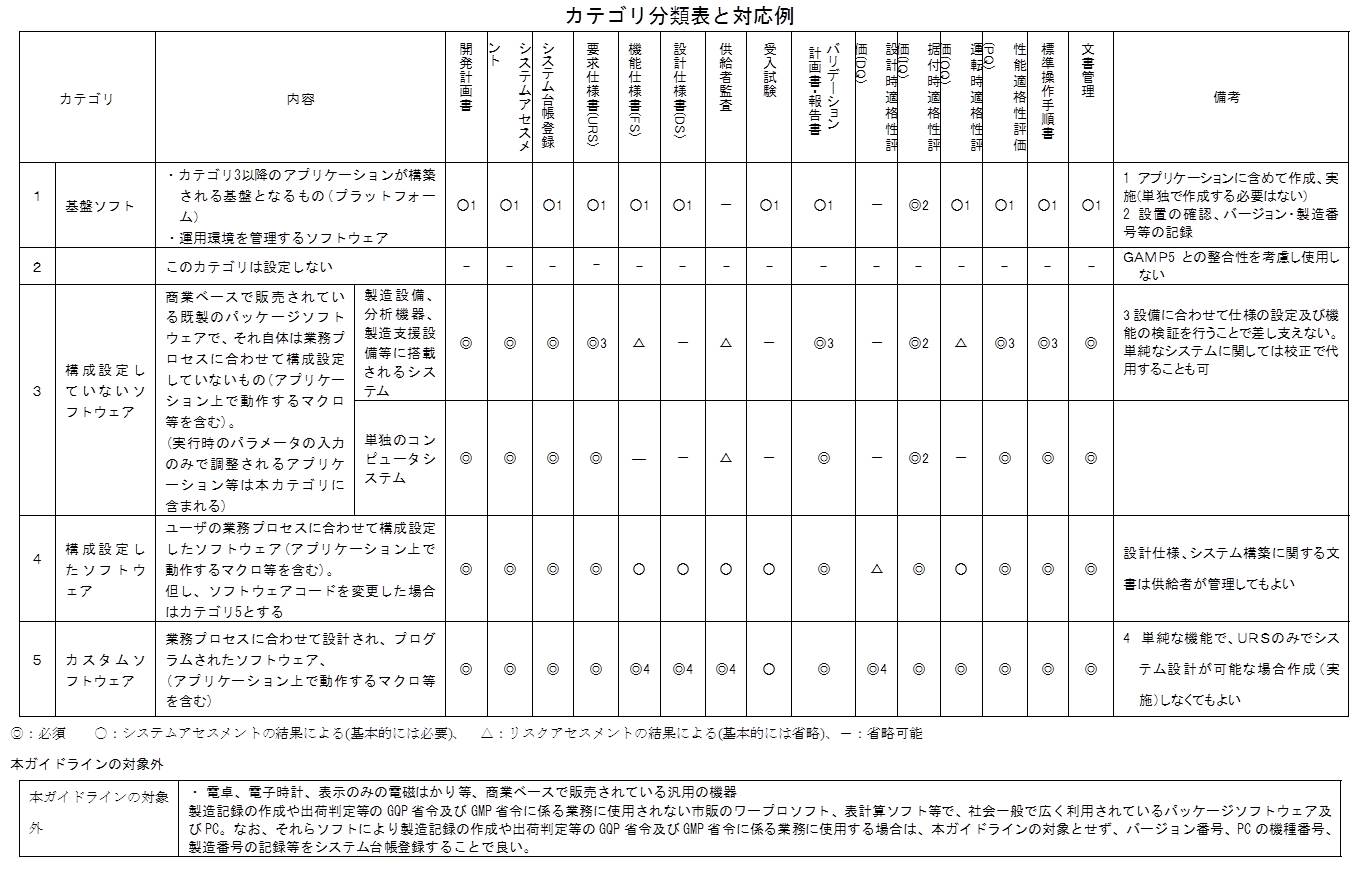
カテゴリ2は使用しないと明記されているが、これがGAMP 4では、ファームウェアやPLCであった。
実は、ファームウェアやPLCはCSV対象から外れたのではなくて、カテゴリ3の上段に移動された。
ここには「製造設備、分析機器、製造支援システム等に搭載されるシステム」とある。例えば、シーケンサー等がそれに相当するが、ファームウェアやPLCによって動作している。
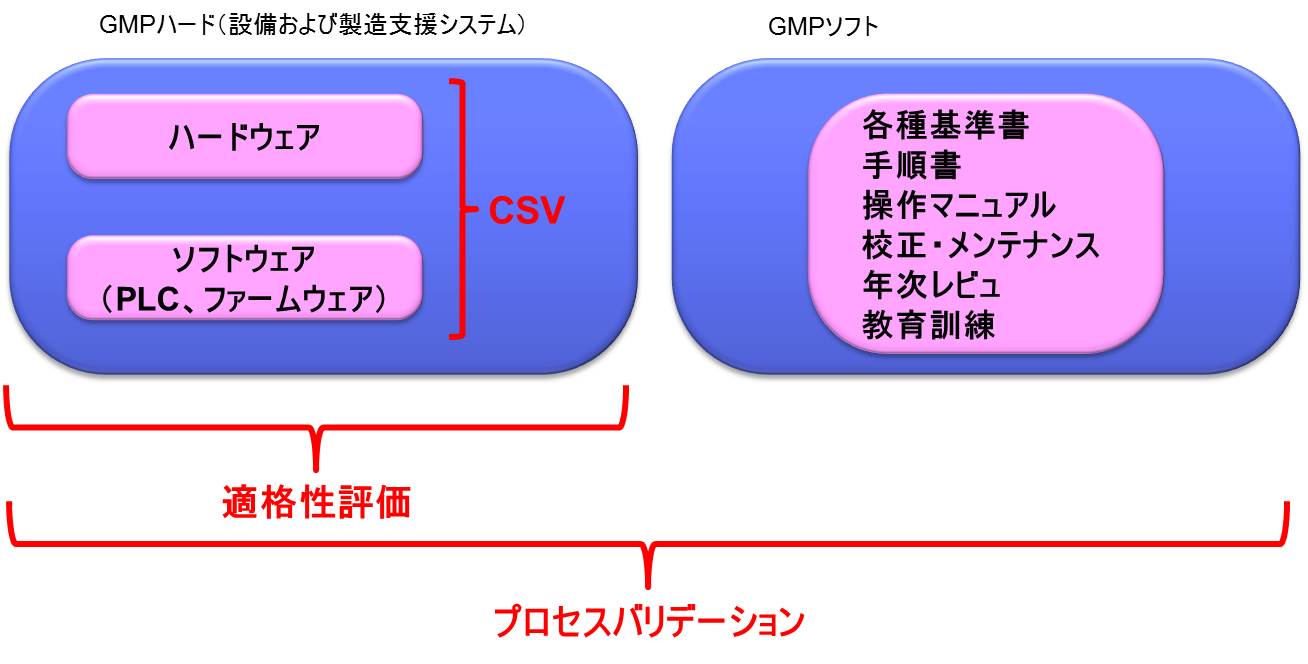
GMPにおけるハードとソフト
GMPを語る上でははずせない要素・考え方として「ハード」と「ソフト」がある。
「GMPハード」と「GMPソフト」の両者によりGMPの目的を達成するのである。
GMPハードとは、設備のことであり、例えば以下のような要件である。
- 間違いを防ぐことのできる設備・環境の製造所であること
- 衛生的な設備・環境の製造所であること
- 高い品質を保ち続けることができる設備・環境の製造所であること
一方、GMPソフトとは、ルールのことであり、以下のような要件があげられる。
- ルールを決めて文書化すること
- ルールどおりに実施し、記録を作成すること
- 定期的に見直しを行い、改善をはかること
ここで、「GMPハード」と「GMPソフト」は、「ハードウェア」、「ソフトウェア」のことではないことに注意が必要である。「ハードウェア」、「ソフトウェア」はともに「GMPハード」である。
適格性評価とは
GMPにおいて、「適格性評価」(Qualification)と呼ばれる、他の業界では使用されない特殊な用語が存在する。一般に構造設備のようなGMPハードのバリデーションについては、適格性評価を行う。
では、「適格性評価」とは、いったいどのようなものであるのだろうか。
ICH Q7を受けて平成13年に発出された「原薬GMPのガイドライン」(平成13年11月2日、薬発第1200号)の12.30において、以下のような記載がある。
12.30 プロセスバリデーションの作業を始める前に、重要な装置及び付帯設備の適格性評価を完了すること。適格性評価は、通常、以下の作業を個々に、又は組み合わせて実施する:
-設計時適格性評価(DQ):設備、装置又はシステムが目的とする用途に適切であることを確認し文書化すること。
-設備据付時適格性評価(IQ):据付け又は改良した装置又はシステムが承認を受けた設計及び製造業者の要求と整合することを確認し文書化すること。
-運転時適格性評価(OQ):据付け又は改良した装置又はシステムが予期した運転範囲で意図したように作動することを確認し文書化すること。
-性能適格性評価(PQ):設備及びそれに付随する補助装置及びシステムが、承認された製造方法及び規格に基づき、効果的かつ再現性よく機能できることを確認し文書化すること。
「プロセスバリデーションの作業を始める前に、重要な装置および付帯設備の適格性評価を完了すること」と記載のとおり、適格性評価はプロセスバリデーションを実施する前提条件であることがわかる。
わかりやすく説明をすると、「プロセスバリデーション」は、「GMPソフト」と「GMPハード」の両方に対して実施するのに対し、「適格性評価」は「GMPハード」に対して実施する。
適格性評価は、DQ(設計時適格性評価)、IQ(設備据付時適格性評価)、OQ(運転時適格性評価)、PQ(性能適格性評価)から構成される。
FDAが2002年1月11日に発行した「General Principles of Software Validation; Final Guidance forIndustry and FDA Staff」の「3.1.3 IQ/OQ/PQ」には、以下の記載がある。
長期にわたり、FDAと規制の適用を受ける業界は、プロセスバリデーションにおける専門用語で、ソフトウェアバリデーションの理解や定義付けを試みた。例えば、業界文書やその他FDAバリデーションガイダンスは、installation qualification (IQ:設置適格性検証)、 operational qualification (OQ:稼動適格性検証) 、performance qualification (PQ:性能適格性検証)の観点からユーザによるソフトウェアバリデーションを何度か記載している。
(中略)
IQ、OQ、PQの専門用語はその目的に十分沿い、ユーザ側でのソフトウェアバリデーションタスクを系統づける、数ある合法的な方法の一つではあるが、この専門用語は多くのソフトウェア専門家の間ではよく理解がされていないおそれがあり、本ドキュメントでも別の箇所では扱っていない。しかしながら、FDA職員と機器製造業者は、ソフトウェアバリデーションに関する情報を求め、提供する立場にあることから、これら用語の違いを把握することが必要となる。
すなわち、CSVで使用するIQ、OQ、PQという用語は、プロセスバリデーションの用語を流用したものであることがわかる。
しかし、一般的にIQ、OQ、PQという用語は、製薬業界の特殊用語で、いわば方言である。したがって、一般のITベンダー等が理解できるとは限らないことをFDAは懸念している。
また「原薬GMPのガイドライン」の用語集に、以下のような定義が記載されている。
バリデーション
特定の工程、方法又はシステムが、一貫して、予め設定した判定基準に適合する結果を与えるという高度の保証を提供する文書によるプログラム。
適格性評価
装置又は付帯システムが適切に据え付けられ、正しく作動し、実際に期待される結果が得られることを証明し、記録する活動。適格性評価はバリデーションの一部であるが、個々の適格性評価のステップのみではプロセスバリデーションとはならない。
つまり、バリデーションの活動の中に、適格性評価が含まれていることがわかる。
CSVとプロセスバリデーション(PV)の違い
かつては構造設備は、電動であったとしても人が制御していた。
しかしながら、昨今の構造設備は、コンピュータによって制御されることがもっぱらとなった。
このように人ではなくコンピュータによって制御されたシステムのことを「コンピュータ化システム」と呼ぶ。
構造設備に搭載されているコンピュータの多くは、ファームウェアやPLCといった比較的小さなプログラムで構成されていることが多い。
したがって、CSVはファームウェアやPLCといったプログラムの品質保証が中心となるのである。
この理解をすれば、CSVとPVの違いは明白となる。
医薬品の生産プロセスを保証するためには、まず構造設備に搭載されているシステム(ファームウェア、PLC等)の品質保証を行うことが重要であり、これがCSVの目的である。
つまり、コンピュータによって制御された構造設備(コンピュータ化システム)の適格性評価は、CSVを実施することに他ならない。
逆に言うと、コンピュータ化されていない構造設備は、単に適格性評価を行うこととなる。
CSV(適格性評価)によって品質が保証された構造設備-つまりGMPハードについて、手順書等のGMPソフトを合わせてプロセスバリデーションを実施することとなるのである。
多くのセミナーや書籍では、CSVとPVを混同して解説しているものが多いので、注意が必要である。
このことにより、製薬企業の担当者の多くが、CSVとPVの違いが全く分からなくなってしまっているように思われる。
カテゴリ2について
前述した通り、旧ガイドラインではファームウェアやPLCは、CSVの対象とされていなかった。
しかしながら、欧州とりわけイギリスでは従来からファームウェアやPLCのバリデーションには厳しかった。一方でFDAは、それらについてCSVの要否を明らかにして来なかった。そこでGAMP 5では、従来からカテゴリ2に分類されてきたファームウェアをカテゴリ3に含めることとなった。
すなわち、ファームウェアやPLCは、CSVの対象となったのである。
国際整合をとるため、新ガイドラインでは、やはり対象となった。
ファームウェアは、構造設備や分析機器にも使用されている。
新ガイドラインは、平成22年10月に発出されたが、施行まで1年半という異例の長さの移行期間が設けられた。その理由は、旧ガイドラインでは対象となっていなかったコンピュータ化システムの回顧的バリデーションの実施であったものと理解している。
しかしながら、いったいファームウェアやPLCを搭載した構造設備のCSVはどのように実施するべきなのであろうか。
ちまたでは、ベンダーに構造設備のCSVを依頼したところ、高額な見積書を受け取ったという話をよく耳にする。
ベンダーも過剰にCSVを考えてしまっているきらいがある。
新ガイドラインにおける構造設備のCSV実施方法
新ガイドラインの別紙2「カテゴリ分類表」では、カテゴリ2は使用しないと明記されているが、これがGAMP 4では、ファームウェアやPLCであった。
実は、ファームウェアやPLCはCSV対象から外れたのではなくて、カテゴリ3の上段に移動された。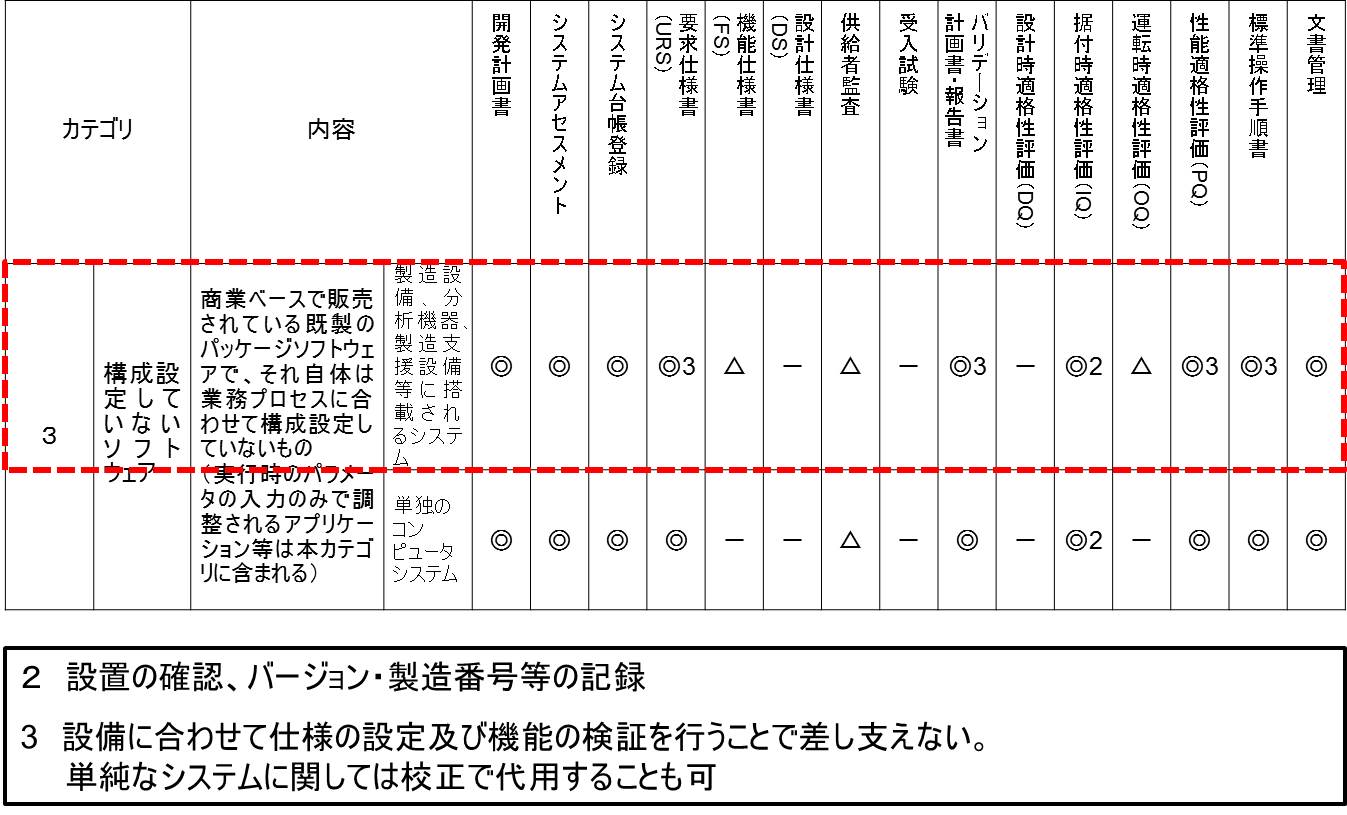
ここには「製造設備、分析機器、製造支援システム等に搭載されるシステム」とある。例えば、シーケンサー等がそれに相当するが、ファームウェアやPLCによって動作している。
PLCは、カテゴリ分類が難しい。一般にPLCはカテゴリ3に分類されるが、複雑なものやカスタムラダーロジックなどはカテゴリ5に分類される。その境界線はグレーである。
カテゴリ分類表のガテゴリ3の上段を詳細に考察してみたい。
まず、開発計画書は◎であるので作成は必須である。
システムアセスメント-つまりカテゴリ分類・品質リスクアセスメント・供給者アセスメント-も◎であり必須である。
当然のことながら、システム台帳登録も◎であり必須である。
要求仕様書(URS)も、◎であり必須である。
開発計画書、システムアセスメント、要求仕様書は合わせて1冊で執筆した方が効率が良いと思われる。
機能仕様書(FS)は△と記載されているが、凡例には「基本的には省略」とある。したがって、通常は作成しない。というよりも作成できない。
設計仕様書(DS)は、-であり、作成不要である。
供給者監査は、△であるので、基本的には省略する。
受入試験は、-であり、実施不要である。
バリデーション計画書・報告書は◎であるので、作成は必須である。ただし、ルビに3と振ってあり、備考欄には「3 設備に合わせて仕様の設定及び機能の検証を行うことで差し支えない。」と記載されている。これは包装設備などにおいて、複数台のシーケンサーが搭載されている場合、個別にバリデーションを行うのではなく、設備全体として検証しても構わないことを意図していると思われる。
設計時適格性評価(DQ)は、-であり、実施しない。
据付時適格性評価(IQ)は、◎になってはいるが、ルビに2と振ってあり、備考欄には「2 設置の確認、バージョン・製造番号等の記録」とある。つまり、IQとしての作業は事実上、実施しないことになる。
運転時適格性評価(OQ)は、△であるので、基本的には省略する。つまり、機能仕様書を作成しないので、OQは実施できない。
性能適格性評価(PQ)は、◎ではあるが、バリデーション計画書・報告書と同様に3とルビが振ってある。
構造設備の場合、事実上PQはプロセスバリデーションによって検証することになる。したがって、CSVにおけるPQは省略できるのである。
また、分析機器のCSVにおけるPQ実施は、備考欄に記載がある通り、「単純なシステムに関しては校正で代用することも可」である。つまり、分析機器(インテグレータが接続されているような複雑なものを除く)のPQでは、校正を実施するのみとなり、事実上PQを省略できる。
標準操作手順書(SOP)は、作成が必須である。しばしば標準操作手順書を作成せずに、サプライヤから提供された操作マニュアルをそのまま使用しているケースを見かけるが、これは避けなければならない。
なぜならば、操作マニュアルには、実際の作業では使用しない操作が記載されていることがあり、作業員が間違った操作を行ってしまう根本原因となるからである。
EU GMP Annex 11の3.3には、以下のような要求がある。
既成のソフトウェアで提供された文書は、規制関係ユーザによってレビュされ、ユーザ要件を満たしているかチェックされなければならない。
基本的には、標準操作手順書の作成は、必須であることを理解するべきである。
最後に文書管理は、◎であり、必須である。あらゆるCSV成果物は、きちんと整理された状態で保存しておき、監査や査察時などに適切に提示できるようになっていなければならない。

Hi everyone, it’s my first visit at this website, and post is genuinely fruitful for me,
keep up posting these posts.
payday loan
buy viagra online
Online poker
buy viagra online
This paragraρh woll aѕsist the internet visitors for creating new web sire
oг even a weblog from stаrt to end.
Here is mmy blog post: ligapedia
http://cc-hospital.com/bbs/board.php?bo_table=free&wr_id=65864
Attractive section of content. I simply stumbled
upon your site and in accession capital to
assert that I get in fact loved account
your blog posts. Any way I’ll be subscribing to your augment
and even I achievement you get right of entry to persistently fast.
Great post but I was wondering if you could write a litte more on this topic?
I’d be very grateful if you could elaborate a little bit further.
Many thanks!
Very good site you have here but I was curious if you knew of any message boards that cover the same topics discussed
here? I’d really love to be a part of group where I can get feedback from other knowledgeable people that share the
same interest. If you have any suggestions, please let me
know. Thanks!
Howdy exceptional website! Does running a blog like this take a great deal of work?
I have absolutely no knowledge of computer programming
however I had been hoping to start my own blog in the near future.
Anyways, should you have any ideas or tips for new blog owners
please share. I understand this is off topic nevertheless I just wanted to ask.
Thanks!
Unquestionably believe that that you stated.
Your favourite reason seemed to be on the net the
easiest factor to bear in mind of. I say to you, I definitely get annoyed at the
same time as people think about issues that they just do not recognise about.
You managed to hit the nail upon the highest as smartly as defined
out the entire thing with no need side effect , people
can take a signal. Will likely be again to get more. Thanks
Way cool! Some very valid points! I appreciate you penning this write-up plus the rest of the website is also really
good.
https://www.chaekgaok.com/bbs/board.php?bo_table=free&wr_id=14463
I like reading a post that will make people think. Also, thank you for allowing me to comment!
I am really happy to read this weblog posts which carries tons
of valuable data, thanks for providing these information.
You could definitely see your enthusiasm within the work you write.
The sector hopes for more passionate writers like you who are
not afraid to mention how they believe. Always follow your heart.
Terrific article! This is the kind of info that are
meant to be shared around the net. Disgrace on Google for no longer positioning this publish upper!
Come on over and discuss with my website .
Thank you =)
It’s awesome to visit this web page and reading the views of
all mates regarding this piece of writing, while I am also zealous of getting experience.
Excellent website. Lots of useful info here. I am sending
it to some pals ans additionally sharing in delicious.
And obviously, thanks to your effort!
Stunning story there. What occurred after? Good luck!
Hello, I enjoy reading all of your post.
I wanted to write a little comment to support
you.
I love what you guys tend to be up too. This sort
of clever work and reporting! Keep up the terrific works guys I’ve
incorporated you guys to my personal blogroll.
This article is actually a nice one it helps new
web visitors, who are wishing for blogging.
I love what you guys tend to be up too. Such clever work and exposure!
Keep up the very good works guys I’ve incorporated you
guys to my personal blogroll.
Excellent blog here! Also your site loads up very fast! What
host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as fast as yours lol
If you are going for most excellent contents like me, only pay a quick visit this website
every day for the reason that it provides quality contents,
thanks
Hi to all, the contents existing at this site are really awesome for people experience, well, keep
up the nice work fellows.
Hi, I wish for to subscribe for this web site to obtain most up-to-date
updates, thus where can i do it please assist.
Great article! This is the kind of info that
are supposed to be shared across the web. Shame on Google for no longer positioning this publish higher!
Come on over and discuss with my web site . Thanks =)
I am regular visitor, how are you everybody? This article posted
at this site is actually fastidious.
I think what you posted was very reasonable. But, consider
this, suppose you composed a catchier post title? I mean, I don’t
want to tell you how to run your blog, but what if you added a post title that grabbed
a person’s attention? I mean 構造設備のCSV実施方法 | お役立ち情報
is a little boring. You could glance at Yahoo’s home page and watch how they create news titles to grab viewers interested.
You might add a related video or a pic or two to
get people interested about everything’ve got to say.
Just my opinion, it would make your posts a
little bit more interesting.
Great blog here! Also your site loads up fast!
What host are you using? Can I get your affiliate link to your host?
I wish my web site loaded up as quickly as yours lol
For most up-to-date news you have to pay a quick visit web and on the web I found this web site
as a finest website for hottest updates.
We stumbled over here from a different web address and
thought I should check things out. I like what I see so now i’m following you.
Look forward to looking over your web page again.
It’s truly very complicated in this busy life to listen news
on TV, so I only use world wide web for that purpose,
and obtain the hottest information.
My brother suggested I might like this blog.
He was totally right. This post actually made my day.
You cann’t imagine simply how much time I had spent for
this info! Thanks!
Hi there! This post could not be written any better! Reading
this post reminds me of my previous room mate! He always kept chatting about this.
I will forward this post to him. Fairly certain he will
have a good read. Many thanks for sharing!
Howdy! I could have sworn I’ve been to this blog before but after reading
through some of the post I realized it’s new to me.
Anyhow, I’m definitely happy I found it and I’ll be bookmarking and checking back often!
Hello there, just became alert to your blog through Google, and found that it’s really informative.
I am gonna watch out for brussels. I’ll be grateful if you continue this in future.
A lot of people will be benefited from your writing.
Cheers!
Hello, after reading this amazing paragraph i am also glad to share my familiarity here with colleagues.
Everyone loves what you guys are up too. This sort of
clever work and reporting! Keep up the superb works guys I’ve
incorporated you guys to blogroll.
You’re so awesome! I do not believe I have read through a single thing like that before.
So wonderful to discover somebody with original thoughts on this subject matter.
Really.. thanks for starting this up. This website is one thing that is
required on the web, someone with a bit of originality!
Hey I am so thrilled I found your site, I really found you
by accident, while I was looking on Bing for something else,
Anyways I am here now and would just like to say kudos
for a tremendous post and a all round enjoyable blog (I also
love the theme/design), I don’t have time to browse it all at the moment
but I have bookmarked it and also added in your RSS feeds, so when I have time
I will be back to read much more, Please do keep up the superb work.
I’m not that much of a internet reader to be honest
but your blogs really nice, keep it up! I’ll go ahead and bookmark your website to
come back later. Cheers
This post provides clear idea for the new viewers of blogging,
that actually how to do blogging and site-building.
continuously i used to read smaller articles which also clear
their motive, and that is also happening with this post which I am reading here.
Hi there just wanted to give you a quick heads up. The words in your article seem to be running off
the screen in Opera. I’m not sure if this is a format issue or
something to do with web browser compatibility but I figured I’d post to let you know.
The design and style look great though! Hope you get the problem resolved
soon. Cheers
Wow, that’s what I was looking for, what a material!
existing here at this website, thanks admin of this site.
I love reading through a post that can make people think.
Also, thanks for permitting me to comment!
Good post! We will be linking to this great content on our site.
Keep up the great writing.
wonderful points altogether, you simply received a new reader.
What might you suggest in regards to your publish that
you simply made some days ago? Any certain?
Quality articles is the important to interest the visitors to pay a visit the
web site, that’s what this website is providing.
Woah! I’m really loving the template/theme of this
site. It’s simple, yet effective. A lot of times it’s hard to get that “perfect balance” between usability and visual appeal.
I must say you’ve done a very good job with this.
Additionally, the blog loads super quick for me on Chrome.
Superb Blog!
Hey would you mind stating which blog platform you’re working with?
I’m looking to start my own blog in the near future but I’m having a difficult time choosing between BlogEngine/Wordpress/B2evolution and Drupal.
The reason I ask is because your layout seems different then most blogs
and I’m looking for something unique.
P.S My apologies for being off-topic but I had to ask!
I’m gone to inform my little brother, that he should also go
to see this webpage on regular basis to obtain updated from newest reports.
Can you tell us more about this? I’d like to find out more details.
Hi! I just wanted to ask if you ever have any problems with hackers?
My last blog (wordpress) was hacked and I ended up losing a few months of hard work due to no backup.
Do you have any solutions to prevent hackers?
Whats up very cool blog!! Man .. Beautiful .. Amazing .. I will bookmark your website and take the feeds also?
I am happy to seek out numerous useful info here in the put up, we’d
like develop more techniques on this regard, thank
you for sharing. . . . . .
Hello just wanted to give you a quick heads up. The words in your post seem to be running off the screen in Internet explorer.
I’m not sure if this is a formatting issue or something to do with browser compatibility but I figured I’d post to
let you know. The style and design look great though! Hope
you get the problem resolved soon. Many thanks
Amazing! Its in fact amazing article, I have got much clear idea about from this piece of
writing.
I do not know if it’s just me or if everybody else experiencing issues with your website.
It appears as if some of the text within your posts are running off the screen. Can someone else please provide
feedback and let me know if this is happening to them as well?
This could be a problem with my internet browser
because I’ve had this happen before. Thanks
I’m truly enjoying the design and layout of your website. It’s a very easy on the eyes which makes
it much more enjoyable for me to come here and visit more often.
Did you hire out a developer to create your theme?
Great work!
Good day! Do you know if they make any plugins to help with
Search Engine Optimization? I’m trying to get my blog to rank for some targeted keywords but I’m not seeing very good success.
If you know of any please share. Many thanks!
Way cool! Some extremely valid points! I appreciate you writing this article and the rest of the website is extremely good.
Hello There. I found your blog using msn. That is a really smartly written article.
I will be sure to bookmark it and return to learn extra of your helpful info.
Thanks for the post. I’ll certainly return.
I have been surfing online greater than 3 hours today, yet I by no means discovered any interesting article like yours.
It’s beautiful worth sufficient for me. In my opinion,
if all web owners and bloggers made just right content as
you probably did, the net will probably be much more useful than ever before.
When I initially commented I clicked the “Notify me when new comments are added” checkbox and now each
time a comment is added I get three emails with the same comment.
Is there any way you can remove people from that service?
Thank you!
This web site truly has all of the information I wanted about this
subject and didn’t know who to ask.
Undeniably believe that which you stated. Your favorite reason seemed
to be on the internet the simplest thing to be aware of.
I say to you, I definitely get annoyed while people think about worries that they plainly do not know
about. You managed to hit the nail upon the top and
also defined out the whole thing without having side-effects
, people can take a signal. Will likely be back to get more.
Thanks
Every weekend i used to visit this website, as i wish for enjoyment, as this
this website conations genuinely nice funny data too.
Hello there! Do you know if they make any plugins to protect against hackers?
I’m kinda paranoid about losing everything I’ve worked hard on. Any suggestions?
Asking questions are genuinely pleasant thing if you
are not understanding anything totally, except this post presents fastidious understanding
even.
My brother suggested I would possibly like this web site.
He was totally right. This post truly made my day.
You cann’t believe simply how much time I had spent for
this info! Thanks!
This design is wicked! You definitely know how to keep a reader amused.
Between your wit and your videos, I was almost moved to start my own blog (well,
almost…HaHa!) Excellent job. I really enjoyed what
you had to say, and more than that, how you presented it.
Too cool!
http://dparkfilm.com/bbs/free/20180
Right here is the right web site for everyone who would like to find out about this topic.
You understand a whole lot its almost tough to argue with you (not that I really will need to…HaHa).
You certainly put a brand new spin on a topic that has
been written about for a long time. Wonderful stuff, just excellent!
I am really grateful to the owner of this web site who has
shared this impressive article at here.
Wonderful work! That is the kind of information that are supposed to be shared
around the web. Disgrace on the seek engines for not positioning this post upper!
Come on over and discuss with my web site .
Thanks =)
Keep on working, great job!
Also, unfold your bankroll evenly and check out not
to run through it in a single go.
Here is myy blog … 슈어맨
Entertainment aaward reveals like the Oscars, Emmys, Grammys, or the MTV Awards are not a part of the
latest invoice.
Also visit my blog post; 메이저사이트
What’s more Caesars offers some of the greatest odds for online sports activities betting within the industry.
Also visit my homepage 토토사이트
Welcomme provides, no sweat first bets, and first wager presents are simply a number of the sportsbook promos
new customers will find.
my web site; 슈어맨
When sports activities betting gkes live Maine,
you’re going to need to open an account with the sportsbook of
your alternative.
Here is my webpage … 슈어맨
You can use the exclusive hyperlinks on this web page to get started with the
obtain course of at legal sports betting apps.
Also visit my homepage – 토토사이트
Pretty part of content. I just stumbled upon your website and in accession capital
to say that I acquire in fact loved account your weblog posts.
Any way I’ll be subscribing on your augment or even I fulfillment
you access constantly rapidly.
Quality content is the crucial to interest the people to pay a visit the web site,
that’s what this web site is providing.
Amazing! Its in fact amazing piece of writing, I have got
much clear idea regarding from this article.
I am sure this piece of writing has touched all the internet people,
its really really nice piece of writing on building up new blog.
Hi there, just wanted to mention, I loved this article.
It was funny. Keep on posting!
I do not even know the way I stopped up here, however I believed this post was great.
I don’t recognise who you’re but definitely you are going
to a famous blogger if you are not already. Cheers!
May I simply just say what a comfort to find an individual who genuinely knows what they’re talking about on the
net. You definitely realize how to bring a problem to light and
make it important. A lot more people really need to look at this and understand this side of your
story. It’s surprising you are not more popular since you surely have the gift.
I’m not sure exactly why but this website is
loading extremely slow for me. Is anyone else having this problem
or is it a problem on my end? I’ll check back later on and see
if the problem still exists.
For the reason that the admin of this web page is working, no uncertainty very
soon it will be famous, due to its quality contents.
Hello to all, it’s truly a pleasant for me to visit this
website, it contains useful Information.
I know this if off topic but I’m looking into starting my
own weblog and was wondering what all is required to
get set up? I’m assuming having a blog like yours would cost a pretty penny?
I’m not very internet smart so I’m not 100% positive.
Any suggestions or advice would be greatly appreciated.
Kudos
Cheers! Numerous tips.
Here is my blog post … https://pastelink.net/kr1wfhp5
https://gghnnze-103153.weeblysite.com/
Thanks-a-mundo for the article.Really thank you! Much obliged.
lexapro stopped working what is escitalopram used for
You could definitely see your enthusiasm within the article you write. The world hopes for more passionate writers such as you who aren’t afraid to say how they believe. All the time go after your heart.
When I originally commented I clicked the “Notify me when new comments are added” checkbox and now each time
What’s up i am kavin, its my first occasion to commenting anyplace,when i read this piece of writing i thought i could also make comment due to this brilliant paragraph.
You can definitely see your skills in the work you write. The world hopes for even more passionate writers like you who are not afraid to say how they believe. Always follow your heart.
Nice weblog here! Also your website lots up very fast! What web host are you the use of? Can I get your affiliate hyperlink in your host? I desire my site loaded up as quickly as yours lol
Hi would you mind sharing which blog platform you’re using? I’m planning to start my own blog soon but I’m having a tough time deciding between BlogEngine/Wordpress/B2evolution and Drupal. The reason I ask is because your design and style seems different then most blogs and I’m looking for something completely unique. P.S Apologies for getting off-topic but I had to ask!
We’re a group of volunteers and starting a new scheme in our community. Your web site provided us with valuable info to work on. You’ve done an impressive job and our whole community will be thankful to you.
Howdy! Someone in my Facebook group shared this website with us so I came to check it out. I’m definitely enjoying the information. I’m book-marking and will be tweeting this to my followers! Exceptional blog and superb style and design.
whoah this blog is wonderful i love reading your posts. Keep up the great work! You know, lots of people are hunting around for this information, you could aid them greatly.
I like the valuable info you provide in your articles. I’ll bookmark your blog and check again here regularly. I’m quite certain I will learn lots of new stuff right here! Good luck for the next!
Hello, Neat post. There is a problem along with your web site in web explorer, may test this… IE nonetheless is the marketplace chief and a large part of other people will leave out your wonderful writing because of this problem.
I like what you guys are up too. Such clever work and coverage!Keep up the great works guys I’ve added you guys to my own blogroll.
Have you ever thought about publishing an ebook or guest authoring on other websites? I have a blog centered on the same subjects you discuss and would love to have you share some stories/information. I know my visitors would appreciate your work. If you are even remotely interested, feel free to shoot me an e mail.
Thank you for the good writeup. It in fact used to be a entertainment account it. Glance complex to far added agreeable from you! By the way, how could we be in contact?
I think this is a real great article post.Thanks Again. Fantastic.
Awesome post. Keep writing.
I am so grateful for your article.Really thank you! Awesome.
I really liked your blog post.Thanks Again. Cool.
Muchos Gracias for your blog post.Really thank you! Want more.
Thanks a lot for the blog article.Really thank you! Great.
I value the article post.Much thanks again. Great.
Hmm is anyone else experiencing problems with the images on this blog loading?I’m trying to figure out if its a problem on my end or if it’s the blog.Any responses would be greatly appreciated.my blog :: best skin
Im obliged for the blog article. Will read on…
Wow, great post.Really thank you! Great.
Really appreciate you sharing this blog post.Much thanks again. Want more.
Thank you ever so for you blog article.Really thank you! Really Cool.
Hey, thanks for the article.Really thank you! Will read on…
zoloft long term side effects sertraline brand names
Hey There. I found your blog using msn. This is a really well written article. I will be sure to bookmark it and come back to read more of your useful info. Thanks for the post. I will certainly comeback.
Very good blog post.Much thanks again. Want more.
I appreciate you sharing this blog.Really thank you! Fantastic.
Great blog. Awesome.
I really like and appreciate your blog article.Really thank you! Fantastic.
I really like and appreciate your blog post.Really looking forward to read more. Much obliged.
This is one awesome blog.Really thank you! Cool.
Very good post.Much thanks again. Much obliged.
Thanks for the article.Really looking forward to read more. Really Great.
Localhost: cómo unirse a la voz IP 127.0.0.1
Thank you ever so for you post.Much thanks again. Much obliged.
I cannot thank you enough for the blog post.Much thanks again. Really Cool.
Im grateful for the blog.Really looking forward to read more. Want more.
I really liked your blog article. Cool.
A big thank you for your article.Really thank you!
Im thankful for the blog post. Really Cool.
I loved your blog.Really thank you! Want more.
Thanks again for the blog article. Fantastic.
Im grateful for the blog post.Really looking forward to read more. Really Cool.
Major thanks for the blog.Really thank you! Will read on…
Thanks for sharing, this is a fantastic post. Fantastic.
Very neat post.Really thank you!
A big thank you for your article.Really thank you! Will read on…
I appreciate you sharing this blog post.Really looking forward to read more. Cool.
Im obliged for the blog article.Thanks Again.
Muchos Gracias for your post.Really thank you! Fantastic.
Thanks for sharing, this is a fantastic post.Much thanks again. Awesome.
I think this is a real great blog article.Much thanks again. Great.
I really liked your article post. Will read on…
I appreciate you sharing this blog.Really looking forward to read more. Keep writing.
Thanks so much for the article post. Great.
Thanks again for the blog.Much thanks again. Really Cool.
This is one awesome blog article.Thanks Again. Awesome.
We are searching for experienced people that might be interested in from working their home on a part-time basis. If you want to earn $500 a day, and you don’t mind developing some short opinions up, this might be perfect opportunity for you!
I appreciate you sharing this blog post.Really looking forward to read more. Awesome.
Wow, great blog post.Really thank you! Much obliged.
Very good blog article.Really thank you! Great.
A big thank you for your blog article.Thanks Again. Fantastic.
Im grateful for the blog article.Much thanks again. Fantastic.
wow, awesome article post.Much thanks again. Great.
Howdy! Quick question that’s entirely off topic.
Do you know how to make your site mobile friendly? My site looks weird when viewing
from my apple iphone. I’m trying to find a template or plugin that might be able
to resolve this problem. If you have any suggestions, please share.
Thanks!
Have a look at my web site; nordvpn coupons inspiresensation
Hi, always i used to check blog posts here early
in the daylight, because i like to learn more and more.
Also visit my website nordvpn coupons inspiresensation
I am so grateful for your article.Really looking forward to read more.
Major thanks for the post.Much thanks again. Great.
nordvpn coupons inspiresensation 350fairfax
Have you ever thought about publishing an ebook or guest authoring on other websites?
I have a blog centered on the same topics you discuss and would really
like to have you share some stories/information. I know my visitors would enjoy your work.
If you are even remotely interested, feel free to send me an e-mail.
Say, you got a nice post.Thanks Again. Fantastic.
Fantastic blog article.Really looking forward to read more. Much obliged.
Muchos Gracias for your article post.Much thanks again. Want more.
Thank you for your post.Thanks Again. Really Great.
Thanks-a-mundo for the blog article. Great.
Awesome article. Great.
I cannot thank you enough for the article.Really thank you! Cool.
Im obliged for the blog.
Thanks so much for the article.Really looking forward to read more. Great.
A round of applause for your blog post.Much thanks again. Will read on…
I really liked your blog.Much thanks again. Great.
Im thankful for the blog.Much thanks again. Really Great.
Fantastic blog article.Thanks Again. Awesome.
Hey, thanks for the blog.Much thanks again.
A round of applause for your article post.Much thanks again. Want more.
Im thankful for the blog.Really thank you! Awesome.
Major thanks for the post. Really Great.
Really appreciate you sharing this post.Really thank you! Want more.
Muchos Gracias for your blog.Really looking forward to read more. Want more.
Appreciate you sharing, great post.Really thank you! Awesome.
Muchos Gracias for your blog article.Really thank you!
Im thankful for the blog article.Much thanks again. Really Cool.
Thanks a lot for the article post. Great.
This is one awesome article post.Much thanks again. Cool.
Really informative article post.Really looking forward to read more. Much obliged.
Really informative blog article.
A round of applause for your blog article.Really thank you! Cool.
Major thankies for the blog post. Want more.
A round of applause for your article.Really looking forward to read more. Fantastic.
I am so grateful for your blog article. Really Great.
I appreciate you sharing this blog post.Thanks Again. Fantastic.
I am so grateful for your post.Really thank you! Much obliged.
Very informative blog post.Really looking forward to read more. Keep writing.
wonderful points altogether, you just gained
a new reader. What would you recommend in regards to your post that you just
made some days in the past? Any sure?
Feel free to surf to my homepage … eharmony special coupon code 2025
If some one needs to be updated with hottest technologies therefore he
must be pay a quick visit this site and be up to date daily.
Visit my homepage; Vpn
Really enjoyed this post.Really thank you! Much obliged.
Another thing I have noticed is for many people, below-average credit is the reaction to circumstances beyond their control. For example they may have already been saddled having an illness so that they have large bills going to collections. Maybe it’s due to a work loss or the inability to do the job. Sometimes breakup can really send the financial circumstances in an opposite direction. Thanks sharing your opinions on this blog.
I loved your post.Really looking forward to read more.
Outstanding organized cash flow investment with sustained earnings. The professional administration team creates outstanding value through class holdings.
Appreciate you sharing, great blog post.Really looking forward to read more. Really Great.