設計移管は「FDA 21CRF Part820 Quality System Regulation」の「Subpart C§820.30(h) Design transfer」で規定されている。
| (h) 設計移管各製造業者は手順を確立し維持し、機器設計が製造仕様書に正確に移し換えられることを保証する こと。 |
設計移管とは、設計バリデーションにより妥当性が確認された最終の設計アウトプットを製造の仕様書に正確に移管する作業である。すなわち、設計移管フェーズにおいては、妥当性確認のなされた設計アウトプットを製造プロセスおよび製造仕様に落とし込む。
設計移管においては、事前に設計開発文書および製造方法に関する文書の徹底的な評価を行う必要がある。すなわち、技術的な適切性、設計の安全性および信頼性を確立しなければならない。
医療機器が意図された使用および要求に合致していることを確かめるために、文書化された製造プロセスや仕様書と設計アウトプットを比較するレビュを実施すること。
製造仕様を確立するために用いられるサポーティングドキュメント等は、設計移管時にレビュ・承認すること。
完成医療機器は設計開発段階で定められ、承認された仕様書、原材料、コンポーネントを用いて製造されなければならない。製造段階では、通常の製造において用いられるあらかじめ計画されたものと同一または同様(合理的な理由がある場合に限る)の設備を用いなければならない。
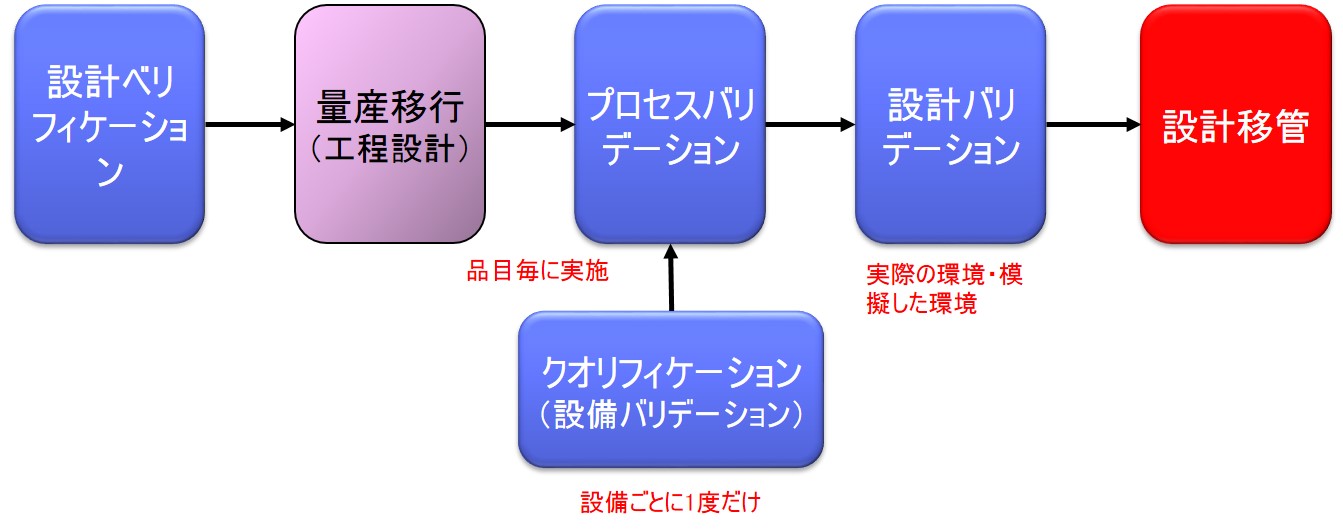
設計移管と量産移行を混同しているケースを多く見かけるが、これは間違いであるので注意すること。
- 参考
21 CFR Part820 Quality System Regulation, FDA 1997
Design Control Guidance For Medical Device Manufacturers, FDA 11 March,1997
FDA査察対応設計管理手順書サンプル
イーコンプライアンスでは、FDAが要求する設計管理に対応した、規程、手順書、様式のサンプルを販売しています。
ぜひご購入をご検討下さい。

I’m not that much of a internet reader to be honest but your blogs
really nice, keep it up! I’ll go ahead and bookmark your
site to come back in the future. All the best
Excellent post. Keep posting such kind of info on your page.
Im really impressed by it.
Hello there, You’ve done a great job. I will certainly digg it and individually recommend to my friends.
I am confident they’ll be benefited from this site.
Touche. Sound arguments. Keep up the good effort.
You made some good points there. I looked on the web for more
info about the issue and found most individuals will go along with your
views on this website.
WOW just what I was looking for. Came here by searching for naga169
Hello, i read your blog from time to time and i own a similar one and i was just
wondering if you get a lot of spam comments? If so how do you
prevent it, any plugin or anything you can advise?
I get so much lately it’s driving me mad so any assistance is very much
appreciated.
The bonus is evenly split into two $1,500 components for poker and
casino games, each at a 150% deposit match rate.
my web blog – Affordable
Its like you read my mind! You appear to know a lot about this, like you wrote the book in it or
something. I think that you can do with a few pics to drive the message home a
little bit, but instead of that, this is fantastic blog.
A fantastic read. I’ll certainly be back.
Have you ever thought about including a little bit more than just your articles?
I mean, what you say is important and all. Nevertheless think about if you added some great images or video clips to give your
posts more, “pop”! Your content is excellent but with pics and video clips, this blog could undeniably be one of the very
best in its niche. Wonderful blog!
When someone writes an article he/she keeps the
thought of a user in his/her brain that how a user can be aware of it.
Therefore that’s why this article is amazing. Thanks!
whoah this weblog is wonderful i really like reading your articles.
Keep up the great work! You know, lots of people
are hunting round for this information, you
can aid them greatly.
Hello! This post couldn’t be written any better! Reading this post reminds me of my old room mate!
He always kept talking about this. I will forward this page to him.
Pretty sure he will have a good read. Thank
you for sharing!
Pretty part of content. I simply stumbled upon your website and in accession capital to say that I acquire in fact enjoyed account
your weblog posts. Anyway I’ll be subscribing on your augment or even I success you get entry to constantly fast.
Quality articles or reviews is the key to invite the viewers to pay a visit the web site, that’s what this website is providing.
It’s perfect time to make some plans for the longer term
and it is time to be happy. I’ve read this publish and if
I may I desire to counsel you few interesting things or suggestions.
Perhaps you could write subsequent articles relating
to this article. I desire to read even more issues about it!
Usually I do not read post on blogs, however I wish to
say that this write-up very pressured me to try and do so!
Your writing style has been surprised me. Thank you, quite great article.
It’s a shame you don’t have a donate button! I’d without a doubt donate to this
excellent blog! I suppose for now i’ll settle for bookmarking and adding
your RSS feed to my Google account. I look forward to new updates and will share
this website with my Facebook group. Talk soon!
hello there and thank you for your information – I have definitely picked up something new from right here.
I did however expertise a few technical points using this site,
since I experienced to reload the web site lots of times previous to
I could get it to load properly. I had been wondering if your web
host is OK? Not that I’m complaining, but sluggish loading instances
times will very frequently affect your placement in google
and could damage your high quality score if advertising and marketing with Adwords.
Well I am adding this RSS to my e-mail and could look out
for much more of your respective exciting content.
Make sure you update this again soon.
## Understanding the Importance of Link Building
Link building involves getting backlinks from other sites to your own. Such backlinks are
seen as endorsements of trust by Google. The more reputable backlinks
you have, the better your webpage’s chances of appearing more prominently on SERPs.
## Kinds of Links
### Organic Links
Natural links are acquired without requiring effort from the website
owner. These links happen when other websites find your content
useful and link to it.
### Solicited Links
Manual links involve actively acquiring links from other sites.
This can include contacting website owners, asking for links to your content.
### Self-Made Links
User-Generated links are made by inserting your site’s link
to blog comments. Even though these links can give a immediate improvement, they often have low authority and can lead to sanctions from search
engines.
## Efficient Link Building Methods
### Post Creation & Promotion
Creating relevant content that organically gains links is a fundamental strategy for efficient link building.
Below are some advice:
– Create informative content that address common issues
in your niche.
– Develop charts that show detailed information in an digestible manner.
– Produce extensive tutorials on subjects that are thought to be important to
your visitors.
### Guest Posting
Guest articles is a further efficient strategy to acquire high-quality
backlinks. This involves creating articles for other websites in your field.
Be certain that your guest blogs maintain top quality
and contain a backlink to your website.
### Broken Link Fixing
Broken link fixing is a technique that includes finding broken links on other
pages and proposing your site as a replacement. This not only helps the website owner correct their
broken link but further offers you a valuable backlink.
### Connecting and Collaboration
Building networks with other influencers in your niche is a long-term method for acquiring backlinks.
Listed below are some steps to follow:
– Engage in forums related to your field.
– Share other people’s posts and give constructive comments.
– Work together on joint efforts such as ebooks.
### Social Platforms
Promoting your posts on social media can enhance its reach and potential to get hyperlinks.
Engage with your audience on networks like Twitter and
Reddit to develop a solid brand.
## Measuring the Success of Your Link Building Strategy
### Tools for Link Analysis
Several software are accessible to assist you measure
the performance of your link building efforts. Some popular software such as:
– Google Analytics
– Ahrefs’ Site Explorer
– Moz Pro
– SEMrush’s Backlink Audit
– Majestic
### Indicators to Monitor
When evaluating the success of your link building efforts, consider the following measures:
– DA
– Page Rating
– Quantity of referring domains
– Authority of backlinks
– Visitors generated from backlinks
### Adjusting Your Strategy
According to the information obtained from your evaluation, modify your link
building plan to improve its success. This could involve emphasizing different types of articles,
aiming at new websites, or updating your communication strategy.
## Typical Mistakes in Link Building and How to Prevent Them
### Bad Links
One major frequent errors is acquiring bad links from unrelated or dubious sites.
These links may hurt your webpage’s search engine ranking.
### Too Much Optimization
Employing over-optimized hyperlink text frequently can result in punishments from Bing.
Aim for a diverse mix of hyperlink text.
### Overlooking Nofollow Tags
Even though nofollow tags aren’t convey search engine value, they can still bring hits
and improve recognition.
## Emerging Trends in Link Building
### Machine Learning and Hyperlink Strategy
As the advancement of artificial intelligence, link building strategies are turning more sophisticated.
AI software can aid in identifying relevant backlink
sources and anticipating their effect on site authority.
### Voice-Activated Search and Link Building
The growth of voice-activated search has been transforming the manner data is accessed.
This is likely to impact link building by altering the
focus to natural queries and specific keywords.
## Final Thoughts
Successful link building is a vital aspect of search engine optimization. By understanding the value of high-quality hyperlinks, applying
different methods, and constantly evaluating your campaigns, you are
able to enhance your site’s credibility and attain better positions on Bing.
By remaining informed with the newest trends and preventing common pitfalls, you will move through the
constantly evolving world of website optimization and achieve enduring performance.
After looking into a few of the articles on your website, I honestly
like your way of writing a blog. I saved as a favorite it to
my bookmark webpage list and will be checking back soon. Take a look at my website too and let me
know how you feel.
## Comprehending the Significance of Link Building
Link building involves obtaining links from other sites to your own. Such
links are viewed as approvals of confidence by search engines.
The more high-quality links you have, the greater your site’s probability of
ranking higher on search results.
## Categories of Backlinks
### Natural Links
Editorial links are acquired without requiring effort from the webmaster.
These links occur when other sites discover your content
useful and link to it.
### Manual Links
Solicited links involve proactively seeking links from other sites.
This can involve emailing website owners, requesting links to your site.
### User-Generated Links
Self-Made links are built by adding your site’s link to directories.
Even though these links may provide a fast boost, they
often include low value and can lead to penalties from Google.
## Successful Link Building Strategies
### Content Creation & Distribution
Creating relevant articles that naturally earns links
is a fundamental technique for successful link building. Here are some tips:
– Write valuable content that address common issues in your field.
– Design infographics that present detailed information in an simple format.
– Produce comprehensive guides on areas that are important to your audience.
### Guest Posting
Guest posting is a further successful way to create valuable links.
This entails producing articles for other blogs in your
field. Be certain that your guest posts are of high-quality
and contain a hyperlink to your website.
### Broken Link Fixing
Broken link fixing is a method that includes finding broken links on other pages and suggesting your content as a substitute.
This not only aids the website owner repair their broken link but
additionally gives you a valuable hyperlink.
### Contact and Relationship Building
Building networks with other site owners in your niche is a sustainable strategy for acquiring backlinks.
Listed below are some methods to take:
– Get involved in online communities pertaining to your industry.
– Promote other people’s posts and provide valuable feedback.
– Collaborate on collaborative projects such as research studies.
### Social Networks
Promoting your content on social media can increase its exposure and chance to earn hyperlinks.
Engage with your followers on platforms like
Facebook and Instagram to create a solid digital footprint.
## Evaluating the Success of Your Link Building
Campaign
### Software for Link Analysis
Many tools are accessible to help you assess
the effectiveness of your link building efforts. Some popular tools such as:
– Google Analytics
– Ahrefs’ Site Explorer
– Moz Pro
– SEMrush’s Tools
– Majestic SEO
### Metrics to Monitor
When assessing the success of your link building campaign, consider the next measures:
– DA
– Page Authority
– Amount of backlink sources
– Quality of hyperlinks
– Hits coming from backlinks
### Adjusting Your Strategy
Based on the information gathered from your evaluation, tweak your link
building plan to boost its effectiveness. This could entail
concentrating on other types of articles, aiming at new sites, or
updating your contact strategy.
## Common Pitfalls in Link Building and How to Prevent
Them
### Poor Links
Among the common mistakes is acquiring bad links from unrelated
or dubious pages. Those backlinks can damage your webpage’s SEO.
### Too Much Optimization
Employing exact-match anchor text excessively can result in penalties from search engines.
Target a diverse mix of anchor text.
### Ignoring Nofollow Tags
Even though nofollow links do not pass search engine juice, they
might still drive traffic and improve visibility.
## Emerging Trends in Link Building
### Artificial Intelligence and Backlink Acquisition
With the progress of artificial intelligence, link building techniques are getting more advanced.
AI software can help in finding valuable backlink sources and anticipating their impact
on SEO.
### Voice-Activated Search and SEO
The rise of voice queries has been altering the method information is retrieved.
This is likely to influence backlink acquisition by shifting emphasis to natural queries and long-tail keywords.
## Final Thoughts
Effective link building is a vital part of SEO. By grasping the significance
of authoritative backlinks, using different strategies, and regularly evaluating your efforts, you are able to improve your website’s authority
and attain greater results on search engines.
By staying updated with the latest trends and avoiding frequent errors, you are able to navigate the
ever-changing world of SEO and achieve long-term success.
## Understanding the Value of Link Building
Link building includes obtaining links from other sites to your own.
These backlinks are considered endorsements of confidence by search engines.
The more high-quality hyperlinks you have, the better your site’s
likelihood of ranking higher on SERPs.
## Categories of Links
### Editorial Links
Natural links are earned without any actions from the webmaster.
These links appear when other webmasters find your posts
useful and reference it.
### Outreach Links
Outreach links require proactively requesting links from other webmasters.
This can involve reaching out to influencers,
asking for backlinks to your content.
### Self-Created Links
Self-Made links are created by placing your site’s link to
forums. Although these links might provide a fast boost, they often include limited authority and can lead to punishments from
Bing.
## Successful Link Building Methods
### Content Creation & Distribution
Creating high-quality posts that organically earns links is a core method for successful link building.
Listed below are some advice:
– Create high-quality blog posts that solve common questions in your field.
– Create infographics that present complex information in an easy-to-understand way.
– Create comprehensive tutorials on subjects that are
valuable to your visitors.
### Guest Articles
Guest blogging is an additional effective method
to build authoritative links. This entails writing articles for other publications in your niche.
Be certain that your guest blogs are of top quality and include a hyperlink to
your site.
### Broken Link Repairing
Broken link fixing is a strategy that entails finding broken links on other sites and recommending
your site as a replacement. This not only aids
the website owner repair their broken link but additionally
gives you a high-quality backlink.
### Connecting and Collaboration
Building relationships with other influencers in your field is a long-term technique for link building.
Listed below are some steps to take:
– Get involved in forums about your industry.
– Distribute other individuals’ content and offer valuable comments.
– Partner on collaborative initiatives such as research studies.
### Social Networks
Sharing your content on social media can boost its exposure and potential to get backlinks.
Participate with your followers on sites like LinkedIn and Pinterest
to develop a strong brand.
## Measuring the Success of Your Link Building Campaign
### Applications for Link Analysis
Several software are out there to aid you evaluate
the success of your link building efforts. Some commonly used software such as:
– Google’s Analytics
– Ahrefs
– Moz
– SEMrush
– Majestic
### Metrics to Track
When assessing the success of your link building efforts, consider the
next metrics:
– Domain Authority
– Page Rating
– Number of referring domains
– Relevance of backlinks
– Hits generated from links
### Tweaking Your Approach
Based on the information collected from your analysis, adjust your link building plan to enhance its effectiveness.
This could involve concentrating on other types of articles, targeting different
platforms, or refining your contact method.
## Typical Mistakes in Link Building and How to Overcome Them
### Bad Links
One major frequent pitfalls is obtaining low-quality links from non-relevant or dubious sites.
Those links can harm your site’s online presence.
### Excessive Optimization
Using over-optimized anchor text excessively can result in sanctions from search engines.
Aim for a natural mix of anchor text.
### Neglecting Nofollow Links
While nofollow tags don’t pass search engine juice, they might
still generate traffic and enhance recognition.
## Upcoming Developments in Link Building
### Artificial Intelligence and Backlink Acquisition
Due to the evolution of machine learning, link building methods are turning more complex.
Machine learning software can aid in discovering valuable backlink sources and predicting their effect on SEO.
### Voice Queries and Link Building
The increase of voice queries will be transforming the manner
content is retrieved. This will influence backlink
acquisition by changing emphasis to natural queries and detailed keywords.
## Summary
Efficient link building is a essential component of website
optimization. By comprehending the significance of high-quality backlinks, implementing different techniques,
and continuously monitoring your campaigns, you will improve your
webpage’s authority and attain better results on Bing.
By staying updated with the latest developments and avoiding common mistakes, you will
move through the constantly evolving landscape of search engine optimization and achieve enduring performance.
What a data of un-ambiguity and preserveness of valuable
familiarity regarding unexpected feelings.
## Grasping the Value of Link Building
Link building entails getting links from other sites to your own.
Those backlinks are considered approvals of trust by search engines.
The more reputable links you have, the higher your website’s likelihood of showing up more prominently on SERPs.
## Types of Backlinks
### Organic Links
Natural links are obtained without any actions from the
site owner. These links happen when other websites discover your posts relevant and cite it.
### Outreach Links
Outreach links require deliberately requesting links from other websites.
This can include emailing bloggers, soliciting backlinks to
your site.
### User-Generated Links
Self-Created links are created by inserting your webpage’s link
to forums. Although these links can offer a fast increase, they
often have poor value and can lead to punishments from
Google.
## Successful Link Building Techniques
### Content Creation & Distribution
Creating high-quality posts that naturally earns links is a basic strategy for successful
link building. Below are some suggestions:
– Develop high-quality content that address typical questions
in your niche.
– Create visuals that show intricate information in an digestible manner.
– Create comprehensive manuals on subjects that are relevant to
your audience.
### Guest Posting
Guest blogging is a further efficient method to acquire high-quality backlinks.
This involves writing articles for other websites in your industry.
Ensure that your guest posts are of top quality and contain a link to your website.
### Broken Link Repairing
Broken link building is a technique that involves discovering broken links on other sites and suggesting your page as a alternative.
This does more than aids the webmaster correct their broken link but further gives you a authoritative hyperlink.
### Connecting and Relationship Building
Building relationships with other influencers in your field is a
enduring technique for link building. Below are some steps to consider:
– Get involved in online communities pertaining to your niche.
– Share other people’s posts and give valuable comments.
– Partner on collaborative initiatives such as ebooks.
### Social Platforms
Sharing your posts on social networks can boost its exposure and likelihood to get links.
Participate with your community on networks like Twitter and Reddit to
build a solid digital footprint.
## Assessing the Success of Your Link Building Efforts
### Applications for Link Analysis
Several software are available to help you evaluate the performance of your link building strategy.
Some well-known software are:
– Google Analytics
– Ahrefs’ SEO Tools
– Moz Pro
– SEMrush’s Backlink Audit
– Majestic SEO
### Indicators to Monitor
When measuring the effectiveness of your link building efforts, look
at the next indicators:
– Domain Authority
– Page Authority
– Number of linking domains
– Quality of links
– Traffic referred by hyperlinks
### Adjusting Your Approach
Based on the results collected from your evaluation, adjust your link building
approach to boost its performance. It might include concentrating on other types of content, targeting different platforms, or
updating your communication approach.
## Typical Pitfalls in Link Building and How to Overcome Them
### Bad Links
One major typical pitfalls is get bad links from non-relevant or
low-authority pages. These links can harm your webpage’s online presence.
### Over-Optimization
Using keyword-rich link text excessively can cause punishments
from search engines. Aim for a diverse variety of hyperlink text.
### Ignoring Nofollow Tags
Even though nofollow links do not pass SEO
juice, they might nonetheless generate visitors and build brand awareness.
## Emerging Trends in Link Building
### Artificial Intelligence and Hyperlink Strategy
With the advancement of artificial intelligence, link building strategies are getting more complex.
Artificial intelligence tools can assist in identifying high-quality backlink sources and forecasting their effect on SEO.
### Voice Queries and Backlinks
The increase of voice-activated search has been changing the manner
content is consumed. This is likely to affect hyperlink strategies by altering emphasis to
natural queries and specific search terms.
## Summary
Effective link building is a vital part of website optimization. By understanding the significance of high-quality backlinks, applying different techniques, and regularly
measuring your efforts, you can enhance your website’s ranking and achieve higher results on Google.
By staying informed with the newest trends and preventing
common mistakes, you will move through the ever-changing landscape of
SEO and achieve sustainable success.
Ahaa, its fastidious discussion on the topic of this paragraph at this place at this
weblog, I have read all that, so at this time me also commenting at this
place.
## Understanding the Value of Link Building
Link building entails obtaining backlinks from other webpages to
your own. These backlinks are viewed as votes of credibility by Google.
The more reputable hyperlinks you get, the higher your site’s chances of showing up more prominently on SERPs.
## Categories of Backlinks
### Natural Links
Natural links are obtained without actions from the webmaster.
These links happen when other websites find your articles useful and link to it.
### Manual Links
Manual links require proactively acquiring links from other
sites. This can include contacting website owners, asking for hyperlinks to your
content.
### Self-Created Links
Self-Made links are made by inserting your site’s link to blog comments.
While these links might give a quick increase,
they usually come with poor authority and can lead to penalties from
Bing.
## Efficient Link Building Methods
### Article Creation & Promotion
Creating valuable content that automatically earns links is a basic strategy for effective link building.
Listed below are some advice:
– Write high-quality content that answer frequent problems in your
field.
– Design visuals that show detailed information in an digestible way.
– Produce extensive tutorials on topics that are considered valuable to your visitors.
### Guest Posting
Guest blogging is a further successful way to create high-quality backlinks.
This includes writing posts for other websites in your niche.
Be certain that your guest blogs are of high-quality
and include a hyperlink to your page.
### Broken Link Fixing
Broken link fixing is a method that involves finding broken links
on other pages and suggesting your site as a substitute.
This doesn’t just assists the webmaster correct their
broken link but further provides you a high-quality backlink.
### Contact and Collaboration
Building relationships with other webmasters in your niche is a long-term method for
building links. Below are some actions to follow:
– Get involved in forums related to your field.
– Distribute other users’ posts and give constructive feedback.
– Work together on joint projects such as webinars.
### Social Media
Distributing your posts on social platforms can increase its
reach and potential to acquire links. Interact with your community on sites like Facebook
and Pinterest to develop a robust online presence.
## Assessing the Performance of Your Link Building Strategy
### Software for Link Analysis
Several software are accessible to assist you evaluate
the effectiveness of your link building efforts. Some commonly used applications are:
– Google Analytics
– Ahrefs
– Moz’s Link Explorer
– SEMrush’s Tools
– Majestic’s Tools
### Measures to Track
When assessing the effectiveness of your link building efforts,
look at the following metrics:
– DA
– Page Authority
– Quantity of backlink sources
– Relevance of hyperlinks
– Visitors referred by backlinks
### Modifying Your Approach
Depending on the data collected from your analysis, tweak your
link building strategy to improve its performance. This might include concentrating on different types of articles, aiming at other sites,
or improving your outreach strategy.
## Typical Errors in Link Building and How to
Prevent Them
### Poor Links
Among the typical mistakes is obtaining poor links from non-relevant or spammy pages.
Such backlinks may hurt your website’s SEO.
### Excessive Optimization
Using over-optimized anchor text frequently can lead to penalties from Bing.
Target a balanced variety of anchor text.
### Ignoring Nofollow Links
Even though nofollow attributes do not pass
SEO authority, they might nevertheless generate visitors and improve brand
awareness.
## Upcoming Developments in Link Building
### Artificial Intelligence and Hyperlink Strategy
Due to the advancement of machine learning, link building strategies are turning
more sophisticated. AI applications can help in discovering high-quality hyperlink prospects and forecasting their impact on SEO.
### Voice-Activated Search and SEO
The growth of voice-activated search will be altering the method data is consumed.
This will impact link building by altering emphasis to natural language and detailed keywords.
## Summary
Successful link building is a crucial aspect of SEO. By grasping the importance of reputable backlinks, using
diverse methods, and constantly measuring your campaigns, you are able to boost your site’s authority and attain greater rankings on Google.
By remaining current with the most recent changes and avoiding common mistakes, you
can operate in the dynamic world of search engine optimization and
reach long-term results.
A bankroll is basically the quantity of income that you
have to devote at any offered session.
my homepage :: Simple
There are 4 tribal casinos where you can play on slott machines and some table games.
Also visit my blog post: Sale
Social media marketing has become a vital part of any promotional approach.
In today’s internet era, ignoring the power of networks such as Twitter, Instagram, Facebook, and Pinterest.
These social networks provide remarkable opportunities to reach millions of users worldwide.
1. Creating a Robust Profile
To succeed in social media marketing, companies should primarily create a strong presence
on their chosen platforms. This requires designing visually
appealing pages that highlight the business’s ethos and message.
Consistent branding, which includes logos, color themes, and tone, is essential.
It helps in building recognition and trust among fans.
2. Content is King
Creating high-quality material is at the heart of social media marketing.
Content should be related to the audience’s interests and offer value.
This can include how-to guides, entertaining videos, and attractive graphics.
Consistent posting ensures the audience engaged and encourages interaction.
3. Leveraging Influencers
Collaborations with influencers has attained immense importance in recent years.
Influencers enjoy engaged followings that rely on their recommendations.
By teaming up with suitable influencers, businesses can tap into new followers and enhance their
trustworthiness.
It is crucial to choose influencers who match the brand’s values and target audience.
4. Utilizing Analytics
Online sites provide a abundance of data that can be utilized to optimize
promotional efforts.
Examining engagement rates, audience size, and sales data allows organizations to comprehend
what works and what fails to.
This data can direct future content creation, making sure efforts are more targeted
and effective.
5. Utilizing Paid Promotions
Despite free engagement is beneficial, utilizing paid ads can significantly enhance reach on social media.
Networks such as Facebook, Instagram, and LinkedIn give various advertising options for various financial plans
and targets.
Such advertisements can be targeted considering age groups, geographic regions, and activity patterns,
ensuring they reach the intended viewers.
6. Fostering Community
Interaction is essential to building an engaged community
on social media. Replying to messages, thanking shares, and engaging in discussions aids create strong
connections with followers.
This makes more relatable the brand and fosters a sense of community, leading to greater loyalty.
Final Thoughts
Social media marketing is an ongoing journey that requires consistency, innovation, and strategic planning.
By emphasizing creating a solid foundation, producing engaging content, leveraging
influencers, harnessing data, using advertising, and engaging with the audience, businesses
can reach noteworthy results in the challenging world of social media
marketing.
Great post. I was checking constantly this blog and I’m impressed!
Extremely helpful info particularly the last part :
) I care for such information much. I was looking for
this particular info for a long time. Thank you and good luck.
I’m really impressed with your writing skills and also with the layout on your weblog.
Is this a paid theme or did you modify it yourself?
Anyway keep up the nice quality writing, it’s rare to see
a great blog like this one these days.
This post provides clear idea designed for the new viewers of blogging, that
genuinely how to do blogging.
Because the admin of this web site is working, no doubt very rapidly it will be famous, due to its feature contents.
Digital staging solutions are increasingly crucial among real estate agents.
Due to advancements in technology, these tools allow realtors to craft stunning virtual environments
that appeal to potential buyers.
Gone are the days when traditional staging was mandatory.
Now, virtual staging presents a cost-effective yet effective approach.
Realtors can present listings with enhanced appeal eliminating the need for investing a lot on actual
home staging.
The process is straightforward. Professional pictures of the property are captured.
These images get uploaded into the virtual home staging application. Utilizing multiple furnishing options and tools, users
can digitally decorate the rooms. Options include from a wide range of furniture styles,
from contemporary to classic.
An important benefit of virtual staging lies in its adaptability.
Professionals can seamlessly modify the decor to meet diverse preferences.
As an illustration, a lounge can change from a sleek aesthetic
to a cozy rustic ambiance in a short time.
In addition, virtual decor solutions assist prospective clients
to visualize what the home could be. Empty rooms often look
cold and small. By adding digital furniture, areas seem bigger and more livable.
This can lead to quicker transactions and higher offers.
An important aspect that highlights virtual home staging. Physical
staging requires a substantial investment, sometimes costing thousands of dollars.
On the other hand, digital decor is affordable. Costs generally vary from several hundred dollars per space, rendering it a
cost-effective solution for numerous agents.
There are several digital staging applications that
realtors can use. Some of the most popular options are BoxBrownie, Virtual Staging Solutions, and Visual Stager.
Each tool offers distinct capabilities, like a vast library of furniture styles, intuitive controls, and quick turnaround times.
In closing, virtual staging software is changing
the property market. This technology delivers agents
an effective method to showcase properties at their best.
With its cost-effectiveness, versatility, and visual appeal, virtual staging is the
new standard in real estate marketing.
Digital staging solutions are increasingly crucial for
realtors. With cutting-edge tech, these
applications allow realtors to create stunning digital interiors that
attract buyers.
The era is over where actual furniture was
mandatory. Nowadays, virtual staging presents a cost-effective and time-saving alternative.
Property professionals can showcase properties at their
finest eliminating the need for spending thousands on real furniture.
The process is easy. High-quality photos of the home are taken. These
images get uploaded into the virtual home staging application. Using different design elements and features, users can virtually furnish the property.
They can choose from an extensive array of furniture styles, from modern to classic.
One of the major benefits of virtual decor is found in its versatility.
Realtors can easily update the design to match various clientele.
For instance, a family room can be transformed from a sleek aesthetic to a warm rustic vibe in a
short time.
Additionally, digital staging assist prospective clients to see how a space can look.
Bare spaces often look unappealing and cramped. With virtual furniture, spaces seem bigger and more welcoming.
This often results in faster sales and more competitive
bids.
Another major consideration that highlights virtual home staging.
Using actual furniture is costly, sometimes costing several thousand dollars.
Conversely, digital decor is affordable. Costs generally vary from a few hundred dollars per area,
making it a financially viable solution for many realtors.
Various virtual staging software on the market today.
A few of the leading choices such as BoxBrownie.com, Virtual Staging Solutions, and Visual Stager.
All application offers specific advantages, such as
a vast library of furniture styles, user-friendly interfaces,
and quick turnaround times.
In summary, virtual staging software is changing the property market.
It offers real estate professionals an effective way to showcase properties most appealingly.
Given its affordability, versatility, and visual appeal, virtual
staging is the future in real estate marketing.
The minimum deposit is $ten, the maximum vaies and
all deposits are absolutely free aand immediate.
My web site – 카지노친구
Virtual staging software are becoming essential among real estate agents.
With advancements in technology, such software allow realtors to design stunning 3D spaces that appeal to potential buyers.
The era is over where actual furniture was mandatory.
Now, virtual staging offers a cost-effective and time-saving alternative.
Realtors can display homes at their finest without needing investing a lot on actual home staging.
The method is simple. High-quality photos of the home are photographed.
These images are transferred into the virtual home staging application. Using various design elements and tools, users can virtually
furnish the space. Options include among numerous interior designs,
from modern and traditional.
A key advantage of digital home staging is found in its
versatility. Professionals can easily update the decor
to suit different tastes. For instance, a living room can switch from
a minimalist aesthetic to a inviting country feel with just a
few clicks.
Additionally, digital staging assist potential homeowners to imagine what the home could be.
Unfurnished areas often look uninviting and small.
By adding digital furniture, rooms appear bigger and more inviting.
This often results in speedier closings and more competitive bids.
Another major consideration that supports virtual home staging.
Using actual furniture is costly, frequently amounting
to thousands of dollars. On the other hand, digital decor costs a fraction. Costs generally vary from several hundred dollars per space, making it a cost-effective option for many
realtors.
There are several virtual decor tools available
on the market. A few of the leading options such as BoxBrownie.com, Virtual Staging Solutions, and VisualStager.com.
All tool presents unique features, such as a vast library of
furniture styles, intuitive controls, and fast processing.
In summary, digital staging tools are transforming the real estate industry.
They provide agents a powerful tool to showcase properties most appealingly.
Due to its economic advantages, versatility, and aesthetic impact, virtual home design is here to stay for property sales.
If you’re into poker, these bonuses will be
matched by an identical poker bonus – basically doubling
tthe amount oon offer you.
Here is my web site – premium
Everyone loves what you guys are usually up too.
Such clever work and reporting! Keep up the superb works guys I’ve included you guys to my own blogroll.
Hey! This is my 1st comment here so I just wanted to give a quick shout out and tell you I genuinely enjoy reading your blog posts.
Can you suggest any other blogs/websites/forums that
cover the same topics? Thanks a ton!
It’s difficult to find well-informed people about this
subject, but you sound like you know what you’re talking about!
Thanks
Hey there! Do you know if they make any plugins to protect
against hackers? I’m kinda paranoid about losing everything
I’ve worked hard on. Any tips?
Music sheets and scores act as the guide for musicians.
Music scores and scores depict how works should be played.
Elements of Music Sheets and Scores
1. **Staff:** A framework of lines and spaces used to notate musical
pitches.
2. **Signs:** Symbols used to denote the pitch range of the notes.
3. **Tones:** Representations of musical sound with pitch and duration.
4. **Rests:** Notations that represent periods of silence.
5. **Time Signature:** Shows the number of beats in each measure and the note value of each beat.
6. **Tonality:** Indicates the key of the music by specifying which notes are sharp or flat.
7. **Intensity:** Notations indicating the intensity of the music.
8. **Phrasing:** Instructions on how to perform each note or phrase.
9. **Pace:** The speed at which the piece should
be performed.
10. **Ornaments:** Indications of additional notes for expressive effect.
Reading Music Sheets and Scores
Understanding music sheets and scores demands awareness of the various elements and signs
used.
Benefits of Learning to Read Music Sheets and Scores
1. **Enhanced Musical Understanding:** Improved knowledge of
music sheets leads to a better grasp of music theory.
2. **Greater Flexibility:** Being able to read music increases a musician’s versatility.
3. **Better Communication:** Musicians who read music can collaborate
more effectively.
4. **Archiving:** Documenting music through scores ensures its
longevity.
5. **Satisfaction:** Learning to read music can be a deeply fulfilling and rewarding experience.
Tips for Beginners
1. **Start Simple:** Begin with simple pieces and gradually move to more complex ones.
2. **Practice Regularly:** Consistent practice helps reinforce learning.
3. **Take Advantage of Tools:** Many resources are available
online to help beginners learn to read music.
4. **Seek Support:** Seek support from others who are also learning to
read music.
5. **Keep Trying:** Learning to read music takes time and effort.
Advanced Techniques
1. **Instant Interpretation:** Instant interpretation of music without needing to practice beforehand.
2. **Changing Keys:** Modulating music to a different
key.
3. **Building Chords:** Creating harmonies to complement a primary melody.
4. **Ad-Libbing:** Ad-libbing music as it is played.
5. **Expressive Playing:** Playing written music with personal flair and expressiveness.
Famous Composers and Their Scores
1. **Ludwig van Beethoven:** Known for his complex and emotionally powerful compositions.
2. **W. A. Mozart:** Celebrated for his clarity, balance, and
natural elegance in music.
3. **J. S. Bach:** Renowned for his complex and polyphonic music.
4. **P. I. Tchaikovsky:** Known for his ability to convey deep
emotion through music.
5. **Debussy:** Famous for his impressionistic and evocative compositions.
Digital vs. Traditional Music Scores
**Benefits of Digital Music:**
– Availability: Easily accessible on various devices.
– Editing: Simple to make changes and adjustments.
– Capacity: Easy to store and organize.
**Pros of Printed Sheets:**
– Physical Interaction: Physical interaction with the music.
– Durability: Stands the test of time.
– Aesthetic Appeal: Holds artistic and historical significance.
The Role of Technology in Music Scores
Technology has revolutionized the way we use music scores.
**Digital Sheet Music Apps:** Apps designed for
digital sheet music make it easier to compose, edit, and share music scores.
**Online Libraries:** Vast collections of
sheet music are available through online libraries.
**Interactive Learning Tools:** Technology-based tools provide interactive music learning
opportunities.
Conclusion
Music sheets and scores are integral to the craft of musicianship.
Whether you are new or an experienced player, understanding
how to read and use music sheets and scores is crucial.
Embrace the path of learning music sheets and scores, and discover the potential that await.
Music sheets hold a deep history that stretches over centuries.
Early Beginnings
The first forms of music notation trace back to early societies.
Ancient Greeks designed rudimentary music notation techniques to preserve
their melodies.
The Greek Contribution
Greek society made important improvements to music notation.
Medieval Innovations
The Middle Ages saw considerable advances in music notation.
The Renaissance Era
Renaissance brought a renewal of culture, including music notation.
Baroque and Classical Periods
During the Baroque periods, music notation developed
further, growing more sophisticated.
The Romantic Era
The Romantic age initiated innovative emotional styles in music
notation.
The Modern Age
In the contemporary period, music notation underwent
substantial changes, incorporating digital tools.
The Digital Revolution
The advent of computer-based scores revolutionized the landscape of music notation.
Key Milestones in Music Notation History
1. **Early Marks:** Ancient Greek symbols that represented musical concepts.
2. **Staff Lines:** Guido d’Arezzo’s revolutionary contributions to music notation.
3. **Baroque Notation:** Development of complex notational
systems in the Baroque period.
4. **19th Century:** 19th-century innovations in music notation techniques.
5. **Contemporary Techniques:** Revolutionary changes in music
notation practices in the modern age.
The Role of Music Sheets in Education
Music sheets serve a important part in music pedagogy.
Notable Composers and Their Contributions
1. **J.S. Bach:** Famed for his intricate and precise notation.
2. **L. Beethoven:** Advanced the use of expressive dynamics in notation.
3. **Wolfgang Amadeus Mozart:** Perfected the Classical approach
to elegant and clear notation.
4. **Chopin:** Innovated in the expressive notation for piano compositions.
5. **Igor Stravinsky:** Revolutionized 20th-century notation with his complex scores.
Evolution of Music Sheets in the Digital Age
The modern era has significantly altered the approach we create music
sheets.
Future of Music Sheets
The future of music sheets holds exciting advancements.
With the progression of technology, the methods composers use
to compose and distribute music sheets will in parallel
advance.
Conclusion
The story of music sheets is intricate, reflecting the evolution of music itself.
From primitive notations to digital scores, music sheets have served as a vital means for recording and transmitting melodies.
As we progress, the story of music sheets will persist, evolving with future advancements.
}
Music sheets possess a rich history that spans over centuries.
Early Beginnings
The earliest types of music notation go back to early societies.
Ancient Greeks created basic music notation methods to preserve their rituals.
The Greek Contribution
Ancient Greece made significant contributions to music notation.
Medieval Innovations
The Dark Ages experienced substantial developments in music notation.
The Renaissance Era
Renaissance period brought a resurgence of culture, including music notation.
Baroque and Classical Periods
During the Classical periods, music notation developed
further, growing more sophisticated.
The Romantic Era
The Romantic period brought about new expressive styles in music notation.
The Modern Age
In the modern era, music notation underwent substantial
changes, incorporating technology.
The Digital Revolution
The arrival of computer-based scores changed the landscape of
music notation.
Key Milestones in Music Notation History
1. **Early Marks:** Ancient Greek symbols that represented musical
concepts.
2. **Medieval Notation:** Development of staff
lines and notation methods in medieval Europe.
3. **The Renaissance:** Development of complex notational systems
in the Baroque period.
4. **Romantic Period:** Increased complexity and detail in Romantic music notation.
5. **Contemporary Techniques:** Introduction of graphic scores and experimental notation in the 20th century.
The Role of Music Sheets in Education
Music sheets serve a important role in learning music.
Notable Composers and Their Contributions
1. **Bach:** Renowned for his elaborate and accurate notation techniques.
2. **L. Beethoven:** Innovated in the use of dynamic and expressive notations.
3. **Mozart:** Excelled in the Classical era’s precise
and clear notation.
4. **Frédéric Chopin:** Innovated in the expressive notation for piano compositions.
5. **I. Stravinsky:** Revolutionized 20th-century notation with his complex
scores.
Evolution of Music Sheets in the Digital Age
The digital age has profoundly transformed the approach we use music sheets.
Future of Music Sheets
The next era of music sheets promises innovative developments.
As technology evolves, the methods musicians use to compose and publish music sheets will so too progress.
Conclusion
The history of music sheets is rich, reflecting the advancement of music itself.
From early marks to electronic sheets, music sheets have served as a fundamental medium for preserving and distributing musical ideas.
As we look ahead, the legacy of music sheets will persist, changing
with future advancements. }
Understanding music sheets is vital for any beginning musician. | Understanding how
to read music sheets is essential for every novice musician. | Mastering the art of reading music sheets is crucial for any beginning musicians.}
What Are Music Sheets?
Music sheets act as written down forms of music notes, showing the note and rhythm of a musical work.
Getting Started with Music Sheets
Learning how to read music sheets begins with becoming familiar
with the essential components of music notation.
Understanding Musical Notation
Music notation involves several key elements, such as
notes, staff, rhythms, and clefs.
This is is actually the foundation in musical notation.
In that music notation, this staff is made up of five flat lines and four spaces.
2. **Clefs
This indicate which note corresponds to the lines and spaces.
| Clefs denote which note the actual note for each line and these five spaces.
| This clefs denote to these lines and also the spaces.}
{There {are actually|actually are|is} {two|two separate|two
distinct} {primary|different|distinct} {clefs|clef|music notes} {used
in|used in various|used in the} {music|musical} {notation|notes|notations}.
| There {are actually|actually are|is} {two|two separate|two distinct} {primary|different|distinct} {clefs|musical notes|clef} {used in|used in various|used in the} {notations|music|musical} {of|music} {these notes|these notes}.
Music sheets and scores serve as the blueprint for musicians.
Music notations and scores illustrate how pieces should
be played.
Elements of Music Sheets and Scores
1. **Staff:** The lines and spaces used to notate the pitch and duration of notes.
2. **Symbols:** Signs that designate the pitch range for notes on the staff.
3. **Notes:** The symbols used to indicate the pitch and duration of sounds
in music.
4. **Pauses:** Symbols indicating silence in music.
5. **Meter:** Shows the number of beats in each measure and the
note value of each beat.
6. **Key Signature:** Specifies the scale in which the
piece is written.
7. **Volume:** Notations indicating the intensity of the music.
8. **Expression:** Instructions on how to perform each note or phrase.
9. **Tempo:** The speed at which the piece should be performed.
10. **Ornaments:** Indications of additional notes for expressive effect.
Reading Music Sheets and Scores
Reading music sheets and scores necessitates understanding of the various parts and signs used.
Benefits of Learning to Read Music Sheets and Scores
1. **Deeper Comprehension:** Improved knowledge of music sheets
leads to a better grasp of music theory.
2. **Greater Flexibility:** Musicians who read music can play a wider variety of pieces.
3. **Improved Interaction:** Improved interaction with other musicians is possible when reading music.
4. **Archiving:** Documenting music through scores ensures its longevity.
5. **Achievement:** Personal fulfillment is found in the ability to read and interpret music.
Tips for Beginners
1. **Begin with Basics:** Begin with simple pieces and gradually move to more complex ones.
2. **Consistent Practice:** Consistent practice helps reinforce learning.
3. **Use Resources:** Use tools and aids such as apps, books,
and online tutorials.
4. **Join a Community:** Joining a music community can provide support
and motivation.
5. **Keep Trying:** Learning to read music takes time and effort.
Advanced Techniques
1. **Sight Reading:** The ability to read
and play a piece of music on the spot without prior preparation.
2. **Transposition:** Altering the key in which music is played.
3. **Creating Harmonies:** Creating harmonies to complement a primary melody.
4. **Ad-Libbing:** Ad-libbing music as it is played.
5. **Interpretation:** Bringing personal interpretation to the performance of music.
Famous Composers and Their Scores
1. **Ludwig van Beethoven:** Known for his complex and emotionally powerful compositions.
2. **W. A. Mozart:** Renowned for his musical brilliance and creativity.
3. **Johann Sebastian Bach:** Famous for his intricate and harmonically rich compositions.
4. **Tchaikovsky:** Celebrated for his emotional and expressive compositions.
5. **Debussy:** Famous for his impressionistic and evocative compositions.
Digital vs. Traditional Music Scores
**Pros of Digital Sheets:**
– Accessibility: Available on multiple platforms.
– Editing: Simple to make changes and adjustments.
– Capacity: Large capacity for storing multiple scores.
**Benefits of Paper Music:**
– Physical Interaction: Provides a tangible, hands-on experience.
– Durability: Durable and long-lasting.
– Artistic Value: Holds artistic and historical significance.
The Role of Technology in Music Scores
Technology has revolutionized the way we use music scores.
**Digital Sheet Music Apps:** Apps like MuseScore, Noteflight, and Sibelius offer powerful tools
for creating, editing, and sharing music scores.
**Online Libraries:** Online libraries provide access to
a wide range of music scores.
**Interactive Learning Tools:** Technology-based tools
provide interactive music learning opportunities.
Conclusion
Music sheets and scores are essential to the art of musicianship.
Whether you are a beginner or are advanced, knowing how to read and interpret music sheets and scores is
valuable.
Embrace the process of understanding music sheets and scores, and uncover the creative opportunities that
await.
Music sheets hold a deep history that stretches over centuries.
Early Beginnings
The initial types of music notation date back to ancient civilizations.
The ancient Greeks designed basic music notation methods to record their musical practices.
The Greek Contribution
Ancient Greece made significant contributions to music notation.
Medieval Innovations
The medieval period experienced considerable progress in music notation.
The Renaissance Era
Renaissance period brought a rebirth of art, including music
notation.
Baroque and Classical Periods
During the Baroque and Classical periods, music notation evolved
further, becoming more detailed.
The Romantic Era
The Romantic age ushered in novel dynamic methods in music notation.
The Modern Age
In the modern era, music notation underwent substantial changes,
adopting technology.
The Digital Revolution
The advent of digital music changed the landscape of music notation.
Key Milestones in Music Notation History
1. **Primitive Symbols:** Ancient Greek symbols that represented musical concepts.
2. **Staff Lines:** Invention of the staff and solmization system
by Guido d’Arezzo in the 11th century.
3. **Baroque Notation:** Evolution of musical
scores in the Classical era.
4. **19th Century:** Increased complexity and detail in Romantic music notation.
5. **Contemporary Techniques:** Adoption of digital notation tools in contemporary music.
The Role of Music Sheets in Education
Music sheets play a important part in music pedagogy.
Notable Composers and Their Contributions
1. **Johann Sebastian Bach:** Renowned for his elaborate and accurate notation techniques.
2. **Ludwig van Beethoven:** Pioneered expressive notations and dynamic markings.
3. **Wolfgang Amadeus Mozart:** Excelled in the Classical era’s precise and
clear notation.
4. **Chopin:** Known for his detailed and expressive piano music notations.
5. **Igor Stravinsky:** Known for his groundbreaking 20th-century notational techniques.
Evolution of Music Sheets in the Digital Age
The contemporary period has profoundly changed the method we create music
sheets.
Future of Music Sheets
The coming age of music sheets foresees intriguing advancements.
As technology advances, the tools artists use to produce and publish music sheets will likewise evolve.
Conclusion
The journey of music sheets holds depth, reflecting the evolution of music itself.
From early marks to electronic sheets, music sheets have functioned as a crucial means for preserving and sharing musical ideas.
As we progress, the legacy of music sheets will continue, adapting with technological progress.}
Music sheets hold a deep history that stretches over millennia.
Early Beginnings
The earliest forms of music notation go back to ancient civilizations.
Ancient Greeks developed basic music notation methods to record their rituals.
The Greek Contribution
Ancient Greece made important improvements to music notation.
Medieval Innovations
The medieval period experienced substantial developments in music notation.
The Renaissance Era
The Renaissance brought a resurgence of art, including music notation.
Baroque and Classical Periods
During the Baroque periods, music notation developed further, becoming more sophisticated.
The Romantic Era
The Romantic period brought about innovative emotional techniques in music
notation.
The Modern Age
In the 20th century, music notation experienced major changes, adopting technology.
The Digital Revolution
The arrival of electronic notation changed the domain of music notation.
Key Milestones in Music Notation History
1. **Ancient Notations:** Ancient Greek symbols that represented musical concepts.
2. **Medieval Notation:** Development of staff lines and notation methods in medieval Europe.
3. **The Renaissance:** Development of complex notational systems in the Baroque period.
4. **Romantic Period:** 19th-century innovations in music notation techniques.
5. **Modern Notation:** Introduction of graphic scores and experimental notation in the 20th century.
The Role of Music Sheets in Education
Music sheets play a important role in music education.
Notable Composers and Their Contributions
1. **J.S. Bach:** Known for his complex and detailed musical scores.
2. **Beethoven:** Pioneered expressive notations and dynamic markings.
3. **W.A. Mozart:** Mastered the Classical style of clear and
elegant notation.
4. **Chopin:** Expanded the use of expressive notations for piano music.
5. **I. Stravinsky:** Revolutionized 20th-century notation with his complex scores.
Evolution of Music Sheets in the Digital Age
The digital age has dramatically changed the approach
we interact with music sheets.
Future of Music Sheets
The coming age of music sheets holds exciting developments.
With the evolution of technology, the techniques composers use to compose and publish
music sheets will in parallel advance.
Conclusion
The story of music sheets is rich, mirroring the advancement of music itself.
From primitive notations to digital scores,
music sheets have functioned as a vital means for preserving and distributing musical ideas.
As we progress, the story of music sheets will continue, evolving with
future advancements.}
Mastering music sheets is vital for any novice musician. | Learning
how to read music sheets is essential for all beginning musician. | Mastering the
art of reading music sheets is crucial for every novice musicians.}
What Are Music Sheets?
Music sheets act as written down forms of music notes, displaying the pitch and rhythm of a music work.
Getting Started with Music Sheets
Understanding how to read music sheets starts with familiarizing
yourself with the basic elements of musical notation.
Understanding Musical Notation
Musical notation consists of a few crucial elements, including notes, staff, rhythms, and clefs.
The foundation in musical notations is this.
In that musical notations, the staff is includes five separate flat lines and four spaces.
2. **Clefs
Clefs indicate what note corresponds to the five lines as well as,
spaces. | Clefs denote the note is meant to the lines and
also these five spaces. | Clefs is meant for these lines
and the spaces.}
{There {are actually|actually are|is} {two|two separate|two distinct} {primary|different|distinct}
{clefs|clef|music notes} {used in|used in various|used in the}
{music|musical} {notation|notes|notations}. |
There {are actually|actually are|is} {two|two separate|two distinct} {primary|different|distinct} {clefs|musical notes|clef}
{used in|used in various|used in the} {notations|music|musical} {of|music} {these notes|these notes}.
Music sheets and scores form the backbone of musical artistry.
Understanding Music Sheets and Scores
Music sheets and scores comprise the written form of musical pieces.
Elements of Music Sheets and Scores
1. **Musical staff:** The lines and spaces used to notate the pitch and duration of notes.
2. **Clefs:** Indicators of the pitch of the notes
written on the staff.
3. **Tones:** The symbols used to indicate the pitch and duration of sounds in music.
4. **Pauses:** Symbols used to indicate moments of
silence in a piece.
5. **Time Signature:** Indicates the metric structure of a piece.
6. **Scale:** Defines the tonality of the piece.
7. **Volume:** Indications of the volume of the music.
8. **Phrasing:** Indicators of the expression or phrasing of notes.
9. **Speed:** Shows how fast or slow the music should be played.
10. **Embellishments:** Symbols showing extra notes for decorative purposes.
Reading Music Sheets and Scores
Reading music sheets and scores necessitates knowledge of the various elements and notations used.
Benefits of Learning to Read Music Sheets and Scores
1. **Improved Knowledge:** Improved knowledge of music sheets leads to a better grasp of music theory.
2. **Broader Skill Set:** Being able to read music increases
a musician’s versatility.
3. **Enhanced Collaboration:** Musicians who read music can collaborate more effectively.
4. **Preservation of Music:** Documenting music through scores ensures its longevity.
5. **Personal Fulfillment:** Learning to read music can be a deeply
fulfilling and rewarding experience.
Tips for Beginners
1. **Keep it Basic:** Begin with simple pieces and gradually
move to more complex ones.
2. **Consistent Practice:** Regular practice is essential for improvement.
3. **Take Advantage of Tools:** Use tools and aids such as apps,
books, and online tutorials.
4. **Join a Community:** Seek support from others
who are also learning to read music.
5. **Keep Trying:** Keep trying and don’t give up, even when it gets tough.
Advanced Techniques
1. **Instant Interpretation:** On-the-spot playing of
music from written notation.
2. **Transposition:** Altering the key
in which music is played.
3. **Building Chords:** Building chords to accompany a musical piece.
4. **Spontaneous Composition:** Creating music spontaneously without prior planning.
5. **Expressive Playing:** Adding personal expression to the performance of written music.
Famous Composers and Their Scores
1. **Beethoven:** Known for his complex and emotionally powerful compositions.
2. **Wolfgang Amadeus Mozart:** Known for his intricate and beautifully structured compositions.
3. **J. S. Bach:** Renowned for his complex and polyphonic music.
4. **Tchaikovsky:** Known for his ability to convey deep emotion through music.
5. **Debussy:** Known for his unique and expressive musical
style.
Digital vs. Traditional Music Scores
**Advantages of Digital Scores:**
– Availability: Convenient for on-the-go use.
– Editing: Flexible for altering and adapting.
– Space: Large capacity for storing multiple scores.
**Advantages of Traditional Scores:**
– Hands-On: Engaging tactile experience.
– Durability: Resilient and less prone to digital failures.
– Aesthetic Appeal: Visually appealing.
The Role of Technology in Music Scores
Technology has revolutionized the way we engage with music scores.
**Digital Sheet Music Apps:** Digital sheet music apps provide convenient
platforms for composing and distributing music.
**Online Libraries:** Vast collections of sheet music are available through online libraries.
**Interactive Learning Tools:** Tools like SmartMusic and Yousician offer
interactive learning experiences for musicians of all levels.
Conclusion
Music sheets and scores are integral to the craft of musical creation.
Whether you are a novice or are skilled, knowing how to read and work with music sheets and scores is advantageous.
Embrace the journey of learning music sheets and scores, and unlock the potential they offer.
The history of music sheets is a rich tapestry that extends across millennia.
Early Beginnings
The first versions of music notation date back to early
societies.
Ancient Egyptians developed simple music notation methods to preserve their
musical practices.
The Greek Contribution
Greek society made notable advancements to music notation.
Medieval Innovations
The Middle Ages saw substantial developments in music notation.
The Renaissance Era
The Renaissance brought a rebirth of music, including music notation.
Baroque and Classical Periods
During the Classical periods, music notation developed further, growing more complex.
The Romantic Era
The Romantic era brought about innovative expressive methods
in music notation.
The Modern Age
In the 20th century, music notation saw substantial changes, integrating
electronic systems.
The Digital Revolution
The advent of digital music transformed the landscape of music notation.
Key Milestones in Music Notation History
1. **Early Marks:** Cuneiform tablets from Mesopotamia that documented early music.
2. **Medieval Notation:** Development of staff lines and notation methods in medieval Europe.
3. **Classical Evolution:** Evolution of musical scores in the
Classical era.
4. **Romantic Period:** Incorporation of expressive dynamics
and articulations in the Romantic era.
5. **Contemporary Techniques:** Revolutionary changes
in music notation practices in the modern age.
The Role of Music Sheets in Education
Music sheets play a important function in learning music.
Notable Composers and Their Contributions
1. **Bach:** Known for his complex and detailed musical scores.
2. **L. Beethoven:** Advanced the use of expressive dynamics
in notation.
3. **W.A. Mozart:** Perfected the Classical approach
to elegant and clear notation.
4. **F. Chopin:** Innovated in the expressive notation for piano compositions.
5. **Igor Stravinsky:** Known for his groundbreaking 20th-century notational techniques.
Evolution of Music Sheets in the Digital Age
The contemporary period has significantly transformed the approach we use music
sheets.
Future of Music Sheets
The future of music sheets foresees innovative developments.
As technology evolves, the techniques artists use to create and
publish music sheets will likewise advance.
Conclusion
The story of music sheets is intricate, reflecting the evolution of music itself.
From primitive notations to modern notations, music sheets have been a crucial medium for recording and transmitting melodies.
As we look ahead, the history of music sheets will continue,
evolving with future advancements. }
Music sheets possess a rich history that stretches over ages.
Early Beginnings
The first versions of music notation date back to early societies.
Ancient Mesopotamians created simple music notation systems
to record their rituals.
The Greek Contribution
The Greeks made notable contributions to music notation.
Medieval Innovations
The Dark Ages witnessed substantial progress in music notation.
The Renaissance Era
Renaissance period brought a renewal of music, including music notation.
Baroque and Classical Periods
During the Classical periods, music notation developed further, becoming increasingly sophisticated.
The Romantic Era
The Romantic period ushered in novel expressive styles
in music notation.
The Modern Age
In the modern era, music notation experienced major changes, integrating
technology.
The Digital Revolution
The arrival of computer-based scores revolutionized the landscape of
music notation.
Key Milestones in Music Notation History
1. **Ancient Notations:** Cuneiform tablets from Mesopotamia that documented early music.
2. **Guido d’Arezzo:** Invention of the staff and solmization system by Guido d’Arezzo in the 11th century.
3. **Baroque Notation:** Advancements in notational precision during the Renaissance.
4. **Romantic Period:** Increased complexity
and detail in Romantic music notation.
5. **Contemporary Techniques:** Revolutionary changes in music notation practices in the
modern age.
The Role of Music Sheets in Education
Music sheets act as a important role in music education.
Notable Composers and Their Contributions
1. **J.S. Bach:** Famed for his intricate and precise notation.
2. **L. Beethoven:** Advanced the use of expressive dynamics in notation.
3. **Mozart:** Perfected the Classical approach to elegant and clear
notation.
4. **Frédéric Chopin:** Innovated in the expressive notation for piano compositions.
5. **I. Stravinsky:** Pioneered 20th-century notational
innovations.
Evolution of Music Sheets in the Digital Age
The modern era has dramatically changed the method we interact with music sheets.
Future of Music Sheets
The next era of music sheets holds innovative developments.
As technology evolves, the techniques composers use to compose and distribute music sheets will so too advance.
Conclusion
The journey of music sheets holds depth, mirroring the progress of music itself.
From primitive notations to digital scores, music sheets have functioned as a vital means for
documenting and distributing musical ideas.
As we progress, the story of music sheets will continue,
changing with each new era. }
Mastering music sheets is vital for any novice musician. | Understanding how to read music sheets is essential for
all beginning musician. | Learning the art of reading music sheets
is crucial for all beginning musicians.}
What Are Music Sheets?
Music sheets are written down forms of music notes, displaying the note as well as,
rhythm of a musical work.
Getting Started with Music Sheets
Understanding reading music sheets begins with becoming familiar with the fundamental elements of musical notation.
Understanding Musical Notation
Music notation consists of many important components, including clefs,
notes, rhythms, and staff.
The basis in musical notations is this.
In musical notations, the staff is includes five different lines and four different spaces.
2. **Clefs
Clefs denote the actual note corresponds to the
lines and also spaces. | This clefs indicate the note is
meant to each line as well as the five different spaces. | This clefs is meant
for the different lines as well as these different spaces.}
{There {are actually|actually are|is} {two|two separate|two distinct} {primary|different|distinct} {clefs|clef|music notes} {used
in|used in various|used in the} {music|musical} {notation|notes|notations}.
| There {are actually|actually are|is} {two|two separate|two distinct} {primary|different|distinct} {clefs|musical notes|clef}
{used in|used in various|used in the} {notations|music|musical} {of|music} {these notes|these notes}.
Opening a t-shirt business can be an thrilling venture for business owners seeking to tap into the apparel
sector. With a solid strategy and commitment, a t-shirt shop may prosper and become
a flourishing business. Here are some essential steps to
think about when starting a t-shirt store.
### Initial Planning
Drafting a comprehensive business plan is vital for the success of your t-shirt shop.
This blueprint should include your audience,
promotional methods, financial plan, and aims.
Identifying your audience is crucial to tailor your t-shirts and advertising to cater to
their interests.
### Design and Production
Designing of your t-shirts is a key element in drawing buyers.
Consider hiring experienced graphic designers to craft attractive and trendy patterns that interest
your customers. Think about employing various processes, like screen printing, direct-to-garment
printing, and vinyl printing, depending on your resources and the
desired quality of the t-shirts.
### Sourcing Materials
Finding dependable suppliers for your products is essential to
ensure high-quality quality. Search for manufacturers that offer
top-notch basic tees in different colors. Creating a good partnership with your manufacturers can help ensure prompt supply and affordable costs.
### Setting Up an Online Shop
In today’s internet era, having an e-commerce site is important
for reaching a more extensive customer base. Build an attractive and efficient e-commerce site to display your apparel.
Use professional photos and comprehensive
information to give customers a clear sense of
what they are buying. Look into integrating features like trusted payment methods, ratings, and network integration to
improve user engagement.
### Advertising and Marketing
Targeted marketing is crucial to bringing in traffic to your t-shirt shop.
Utilize multiple promotional methods, like
social media, email campaigns, partnering with influencers, and paid search
ads. Platforms like Instagram, Facebook, and TikTok enable you to engage a
broad number of people and feature your t-shirts.
Sending newsletters can be an effective strategy to keep your
audience and inform them about new products, sales, and future launches.
Partnering with influencers can also assist in reaching potential
buyers.
### Customer Service
Providing outstanding support is crucial for creating a
faithful customer base. Make sure that your customers
have a great interaction from beginning to end. Respond to questions and issues
promptly and courteously. Offering hassle-free exchanges and fair policies can help building trust with your clients.
### Reviewing Sales
Frequently reviewing your sales can help detect parts for enhancement and modify your {strategies|approaches
Launching a t-shirt business can be an thrilling opportunity for business owners seeking to tap into the clothing sector.
With a solid strategy and commitment, a t-shirt shop may thrive and become a flourishing business.
Here are some essential steps to keep in mind when starting a
t-shirt shop.
### Planning
Drafting a comprehensive business plan is vital for the success of
of your t-shirt shop. This plan should cover the audience,
marketing strategies, budget, and objectives.
Identifying your target market can help adjust your offerings and promotional
activities to meet their needs.
### Creating the T-Shirts
Designing of your t-shirts is a critical aspect in appealing to buyers.
Work with experienced graphic designers to craft attractive
and fashionable graphics that interest your customers. Think
about employing diverse processes, including screen printing, DTG printing, and heat transfer, based on your resources and the desired quality of the apparel.
### Sourcing Materials
Choosing dependable vendors for your t-shirts is essential to make sure of high-quality
goods. Search for vendors that offer top-notch blank t-shirts in various sizes.
Building a good relationship with your manufacturers can help guarantee
prompt delivery and reasonable costs.
### Building an Online Presence
In today’s digital era, having an e-commerce site is crucial for
reaching a wider market. Develop an attractive and easy-to-navigate online store to display your products.
Implement clear photos and detailed descriptions to give customers a better understanding of what they are buying.
Consider including features like safe transactions methods,
customer reviews, and social media buttons to enhance user engagement.
### Promotional Strategies
Effective marketing is key to bringing in customers
to your t-shirt shop. Utilize various marketing channels, such as social media, email campaigns, influencer collaborations, and SEO.
Platforms like Instagram, Facebook, and TikTok allow you to connect with a
large customer base and highlight your designs.
Email marketing is another way to stay in touch
with your customers and update them about latest designs, promotions, and future collections.
Collaborating with influencers can additionally boost in reaching new customers.
### Customer Service
Providing outstanding after-sales service is essential for
building a dedicated customer base. Guarantee that
your clients have a great experience from beginning to end.
Handle questions and complaints promptly and professionally.
Offering hassle-free returns and transparent conditions can assist establishing confidence with your audience.
### Reviewing Sales
Frequently analyzing your business metrics can help spot parts for improvement and
modify your {strategies|approaches
Launching a t-shirt business is an exciting venture for individuals looking to enter the clothing market.
With a solid approach and commitment, your t-shirt shop
may succeed and become a successful venture. Here are some key steps to keep in mind when opening a t-shirt
shop.
### Initial Planning
Drafting a thorough business plan is vital for the success and growth of your t-shirt shop.
This plan must outline your target market, advertising plans, budget, and aims.
Identifying your customer base will help tailor your offerings and advertising to cater to their interests.
### Design and Production
The design of your t-shirts is a key factor in drawing buyers.
Hire talented artists to create eye-catching and
trendy graphics that resonate with your target market.
Think about using diverse processes, such as screen printing, direct-to-garment printing, and heat transfer, according to your budget and the quality you want of the apparel.
### Choosing Suppliers
Choosing reliable manufacturers for your t-shirts is essential to guarantee consistent
quality. Search for manufacturers that offer premium plain t-shirts in various styles.
Building a good connection with your manufacturers will help guarantee prompt supply and reasonable pricing.
### Creating an Online Presence
In today’s digital age, having an e-commerce site is crucial for accessing a
broader market. Build an attractive and easy-to-navigate online store to display your products.
Use high-quality images and detailed information to give customers a
clear idea of what they are getting. Think about integrating features like safe transactions methods, customer
reviews, and network buttons to improve visitor experience.
### Promotional Strategies
Strategic marketing is key to attracting customers to your t-shirt shop.
Utilize multiple promotional methods, including social media, email campaigns,
influencer collaborations, and search engine optimization. Social media platforms enable you to reach a large number of people and highlight your designs.
Sending newsletters is another strategy to engage with your audience and
inform them about new products, sales, and future events.
Partnering with influencers can additionally boost in reaching
new buyers.
### After-Sales Service
Providing exceptional customer service is crucial for creating a faithful audience.
Guarantee that your buyers have a great experience from beginning to end.
Respond to inquiries and problems quickly and courteously.
Offering hassle-free returns and fair policies can aid in creating reliability with your audience.
### Reviewing Sales
Frequently assessing your performance will help
detect areas for growth and modify your {strategies|approaches
Starting a t-shirt store can be an exciting opportunity for individuals looking to explore
the clothing sector. With an effective approach
and dedication, your t-shirt shop could prosper and become a successful enterprise.
Here are some important steps to think about when opening a t-shirt shop.
### Initial Planning
Drafting a comprehensive business plan is essential for the success of of your t-shirt shop.
This plan needs to include your audience, marketing strategies, funding requirements, and aims.
Knowing your audience is crucial to tailor your offerings and
advertising to suit their preferences.
### Creating the T-Shirts
Designing of your t-shirts is a key factor in drawing buyers.
Hire skilled designers to develop attractive and fashionable patterns that interest your
target market. You can employing diverse processes, like screen printing, digital
printing, and vinyl printing, depending on your budget and the
quality level of the products.
### Selecting Vendors
Choosing trustworthy vendors for your materials is crucial to ensure consistent products.
Search for manufacturers that offer top-notch plain t-shirts in diverse sizes.
Building a strong partnership with your vendors can help guarantee on-time delivery
and competitive pricing.
### Building an Online Presence
In today’s online age, having an digital storefront is essential for reaching a broader customer base.
Create an appealing and efficient website to showcase your t-shirts.
Utilize high-quality pictures and detailed information to give customers a good idea of what they are getting.
Consider integrating options like trusted payment systems, ratings,
and social media links to enhance customer interaction.
### Marketing and Promotion
Strategic advertising is crucial to attracting visitors to your t-shirt shop.
Leverage different advertising platforms, such as
social media, newsletters, partnering with influencers, and search engine optimization.
Platforms like Instagram, Facebook, and TikTok provide you to reach a vast number of people and highlight
your t-shirts.
Email campaigns can be an effective method to keep your audience and update them about new arrivals, sales, and upcoming
launches. Partnering with influencers can also assist in reaching targeted clients.
### Customer Service
Providing exceptional after-sales service is crucial for establishing a loyal clientele.
Guarantee that your clients have a great shopping experience
from start to finish. Handle questions and issues promptly and professionally.
Offering easy exchanges and clear terms can help establishing
reliability with your audience.
### Analyzing Performance
Consistently reviewing your performance can help detect areas for enhancement
and adjust your {strategies|approaches
Opening a t-shirt business can be an rewarding opportunity for business owners looking to
explore the fashion market. With the right approach and commitment, a t-shirt shop can succeed and become a
successful enterprise. Here are some key steps to consider when starting a t-shirt business.
### Planning
Drafting a comprehensive plan is crucial for the success and growth of your t-shirt shop.
This blueprint should outline the target market, marketing strategies, financial
plan, and business goals. Identifying your customer base will help customize your t-shirts and marketing efforts to cater to their interests.
### Design and Production
Designing of your t-shirts is a critical aspect in drawing customers.
Consider hiring skilled designers to create unique and
stylish patterns that appeal to your target
market. Think about employing various techniques, such as screen printing, direct-to-garment printing,
and heat transfer, depending on your resources and
the quality you want of the products.
### Choosing Suppliers
Selecting trustworthy suppliers for your products is crucial to ensure reliable products.
Look for manufacturers that supply top-notch basic tees in different
colors. Establishing a strong partnership with your
manufacturers is important to maintain on-time supply and affordable costs.
### Building an Online Shop
In today’s online era, having an e-commerce site is important for
connecting with a more extensive customer base.
Build an attractive and easy-to-navigate online store to feature your apparel.
Implement high-quality photos and detailed information to offer visitors a clear idea of what they are
getting. Consider integrating options like trusted payment
systems, ratings, and social media buttons to boost
user engagement.
### Advertising and Marketing
Strategic marketing is essential to driving traffic to
your t-shirt shop. Utilize multiple marketing channels, like social media, email campaigns, partnering
with influencers, and SEO. Social media platforms enable you
to connect with a broad customer base and showcase your
products.
Email marketing can be an effective way to engage with your
subscribers and update them about new products,
sales, and upcoming launches. Partnering with influencers can additionally help in reaching new
clients.
### Customer Service
Providing exceptional after-sales service is crucial for creating a faithful audience.
Make sure that your buyers have a positive shopping experience
from beginning to end. Respond to concerns and issues efficiently and
professionally. Offering hassle-free exchanges and transparent terms can help creating trust with your clients.
### Reviewing Performance
Frequently reviewing your performance is crucial to identify parts for
growth and modify your {strategies|approaches
Opening a t-shirt shop is an thrilling endeavor for business owners seeking to explore the apparel sector.
With a solid plan and hard work, your t-shirt shop can prosper
and grow into a successful venture. Here are some essential steps to consider when launching a t-shirt business.
### Business Plan
Developing a thorough business plan is crucial for
the success of your t-shirt shop. This plan must include the audience, promotional methods, financial plan, and aims.
Knowing your customer base can help adjust
your products and advertising to cater to their interests.
### Designing and Producing
The design of your t-shirts is a critical aspect in appealing
to buyers. Work with skilled designers to create unique and trendy graphics
that appeal to your target market. Consider utilizing diverse
processes, including screen printing, direct-to-garment printing, and heat transfer, according to your budget and the quality you want of the t-shirts.
### Sourcing Materials
Selecting dependable suppliers for your materials is essential to
ensure high-quality quality. Look for suppliers that offer
high-quality blank t-shirts in different styles. Creating a solid relationship with your vendors will help ensure timely delivery and competitive prices.
### Setting Up an Online Shop
In today’s digital era, having an online presence is crucial for reaching a wider customer base.
Create an attractive and functional website to showcase your apparel.
Implement clear pictures and informative information to provide buyers a clear
sense of what they are getting. Think about including elements like secure payment options, feedback, and social media links to enhance visitor experience.
### Advertising and Marketing
Effective promotion is essential to attracting customers to your t-shirt shop.
Leverage various marketing channels, such as social media, email campaigns,
influencer marketing, and paid search ads.
Social media platforms allow you to reach a broad customer base and highlight your designs.
Sending newsletters can be an effective method to keep your audience and notify them about new products, special offers, and forthcoming collections.
Partnering with influencers can additionally boost in accessing targeted customers.
### Customer Support
Providing excellent after-sales service is crucial for building a
loyal clientele. Ensure that your customers have a positive interaction from beginning to end.
Address questions and complaints efficiently and politely.
Offering convenient refunds and fair terms can help
building trust with your customers.
### Reviewing Metrics
Regularly assessing your performance can help identify areas for growth and adjust your
{strategies|approaches
Nice respond in return of this difficulty with genuine arguments and telling
all on the topic of that.
Hello to all, the contents present at this web site
are genuinely remarkable for people experience, well, keep
up the good work fellows.
Hello would you mind letting me know which web host you’re working with?
I’ve loaded your blog in 3 different browsers and
I must say this blog loads a lot quicker then most.
Can you recommend a good internet hosting provider at a
fair price? Thank you, I appreciate it!
After going over a few of the articles on your website,
I really appreciate your technique of blogging.
I book marked it to my bookmark website list and will be checking back in the near future.
Take a look at my website too and tell me your opinion.
I know this if off topic but I’m looking into starting my own blog and was curious what all is required to
get set up? I’m assuming having a blog like yours would cost a
pretty penny? I’m not very internet smart so I’m not
100% sure. Any suggestions or advice would be greatly appreciated.
Appreciate it
I like what you guys are usually up too. This sort of clever work and
reporting! Keep up the superb works guys I’ve added you guys to blogroll.
WOW Vegas has one particular oof the best selections of Pragmatic Play titles.
Here is my web-site Popular
Good day! This is my first comment here so I just wanted to
give a quick shout out and say I really enjoy reading through your posts.
Can you recommend any other blogs/websites/forums that deal with the same topics?
Appreciate it!
You’re so awesome! I do not think I’ve truly read through
something like that before. So great to discover another person with a few genuine
thoughts on this issue. Really.. thanks for starting
this up. This web site is one thing that’s needed on the
web, someone with a little originality!
Howdy, i read your blog occasionally and i own a similar one and i was just curious if you get a
lot of spam comments? If so how do you stop it, any plugin or anything
you can advise? I get so much lately it’s driving me insane
so any support is very much appreciated.
What’s up to all, it’s truly a nice for me to go to see this
web site, it consists of valuable Information.
I simply could not depart your website before suggesting that
I actually loved the usual information an individual provide to your visitors?
Is going to be back incessantly in order to
investigate cross-check new posts
Thanks for a marvelous posting! I actually enjoyed reading it, you might be a great author.I will remember to bookmark your blog and will come
back from now on. I want to encourage continue your great work, have a nice weekend!
Generally I do not read post on blogs, however I would like to
say that this write-up very forced me to try and do it!
Your writing taste has been amazed me. Thank you,
quite nice post.
Amazing! Its really remarkable paragraph, I have got much
clear idea concerning from this post.
I’m not sure where you’re getting your info, but great
topic. I needs to spend some time learning much more or
understanding more. Thanks for magnificent information I was looking for this info for my mission.
This is my first time pay a quick visit
at here and i am genuinely pleassant to read all at single
place.
Ahaa, its nice dialogue about this paragraph here at this website, I
have read all that, so at this time me also commenting at this place.
Attractive section of content. I simply stumbled upon your site and in accession capital to claim that I acquire
actually enjoyed account your weblog posts. Anyway I will
be subscribing for your feeds or even I fulfillment you get entry to persistently fast.
I was able to find good advice from your
blog posts.
What i don’t realize is in truth how you’re not actually a
lot more well-favored than you might be right now. You’re so intelligent.
You already know therefore considerably with regards to this matter, produced me individually believe it from numerous various angles.
Its like women and men are not fascinated except it’s something
to do with Woman gaga! Your own stuffs outstanding.
Always maintain it up!
AI advancements have integrated themselves into multiple dimensions of life.
A notably provocative branch of this science is the AI undresser.
AI undressers are programs that leverage deep learning to digitally remove clothing from
images of people.
This technology has raised numerous ethical concerns.
Some argue that AI undressers could be leveraged for positive purposes,
such as healthcare evaluation and legal analysis.
In the domain of clinical practice, AI undressers may help physicians in more
accurately examining the internal anatomy of the human form.
This may lead to more accurate medical evaluations and better
treatment plans.
In legal scenarios, AI undressers may aid detectives by
revealing key details that normally remain obscured.
However, the risk for abuse is immense.
AI undressers might be abused for invasive purposes,
leading to severe personal violations.
The capacity to undress someone digitally without their permission creates significant legal issues.
Many individuals think that the availability of AI undressers breaches basic
principles of personal security.
The discussion about AI undressers is expected to intensify as technology further
advance.
There are appeals for strict control and moral rules to regulate the application of AI undressers.
There are those who support a middle ground that
permits the constructive applications of AI undressers
while defending privacy rights.
In summary, AI undressers embody a highly debated crossroads of innovation and ethics.
The ongoing controversy regarding their application underscores
larger social issues about the place of AI in our lives.
As we navigate this bold world of technological advancement, it is crucial that we
consider the ethical implications of our technologies.
AI technology have woven themselves into diverse dimensions of
life. A particularly controversial branch of this science
is the AI undresser.
AI undressers utilize cutting-edge algorithms to virtually remove garments
from images of individuals.
This innovation has sparked numerous ethical questions.
On one hand, AI undressers might be utilized for constructive uses, such as
healthcare diagnosis and criminal analysis.
For example, in the clinical field, AI undressers may aid doctors to more effectively examine the underlying structures of the body.
This might enable improved clinical assessments
and better medical approaches.
In forensics, AI undressers may assist law enforcement by exposing
details that are normally not apparent.
However, the potential for misuse is significant.
There is a considerable possibility that AI undressers could be misused for invasive ends, leading to serious breaches of privacy.
The power to remove clothing from someone virtually without their knowledge creates serious ethical challenges.
Many experts believe that the existence of AI undressers violates fundamental principles of personal security.
As AI continues to develop, the discussion regarding
AI undressers is likely to grow.
There are mounting calls for stringent guidelines and
moral frameworks to manage the deployment of AI undressers.
Many promote for a middle ground that permits the positive applications of AI
undressers while defending personal rights.
In conclusion, AI undressers embody a controversial intersection of innovation and privacy.
The discussion surrounding their use underscores wider social concerns about the role of AI
in our world.
As we progress this brave world of technological advancement, it is crucial that we think about
the social implications of our innovations.
Artificial Intelligence (AI) has evolved into
an essential part of various industries, changing the way we function. One controversial
use of AI is the development of AI undressers.
AI undressers are programs that employ neural networks to virtually take off attire from images of people.
The rise of such technology has stimulated numerous societal
questions.
On one hand, AI undressers could be used for positive purposes, such as
clinical evaluation and legal investigations.
In the domain of healthcare, AI undressers may help
physicians in more accurately understanding the hidden anatomy of the human form.
This might lead to better diagnoses and treatment approaches.
In legal cases, AI undressers could help investigators
by uncovering details that are not apparent.
On the flip side, the potential of exploitation is immense.
There is a considerable risk that AI undressers could be misused for malicious intentions, leading to
major issues of individual rights.
The potential to strip someone digitally without their permission generates significant
legal questions.
Many experts think that the existence of AI undressers violates fundamental rights of personal security.
As AI continues to advance, the debate regarding AI undressers is expected to intensify.
There are calls for rigorous regulation and legal rules to govern the use
of AI undressers.
Many support for a compromise that allows
the beneficial applications of AI undressers while
safeguarding privacy autonomy.
In summary, AI undressers symbolize a highly
debated crossroads of advancement and morality.
The ongoing discussion surrounding their existence reflects wider societal concerns about the place of AI in our lives.
As we navigate this brave age of artificial
intelligence, it is imperative that we consider the ethical ramifications of our technologies.
Artificial Intelligence (AI) has transformed into an indispensable part of various fields,
revolutionizing the way we exist. One hotly debated use of
AI is the emergence of AI undressers.
AI undressers are applications that employ deep learning to digitally strip attire from images of people.
The appearance of such technology has stimulated countless ethical concerns.
On one hand, AI undressers could be utilized for positive uses, such as
medical analysis and forensic analysis.
In the domain of healthcare, AI undressers could help physicians in more accurately examining the
underlying structures of the body.
This may lead to better medical evaluations and better treatment plans.
In legal cases, AI undressers could assist law enforcement by
uncovering information that are not apparent.
On the flip side, the danger of exploitation is immense.
AI undressers might be used for voyeuristic purposes, leading to major privacy breaches.
The capacity to remove clothing from someone virtually without their permission generates significant
moral issues.
There is a strong contention that the availability of AI undressers infringes upon core rights of personal security.
As AI further advance, the debate regarding
AI undressers is expected to intensify.
There are calls for stringent regulation and moral guidelines to govern the
use of AI undressers.
There are those who advocate for a balance that enables the
constructive uses of AI undressers while protecting personal autonomy.
In summary, AI undressers embody a controversial intersection of advancement and privacy.
The debate about their existence underscores broader social
concerns about the role of AI in our world.
As we navigate this bold world of technological advancement, it is vital that we
reflect on the ethical consequences of our advancements.
Artificial Intelligence (AI) has evolved into an integral part of numerous fields, reshaping the way we exist.
One contentious implementation of AI is the emergence of AI undressers.
AI undressers are programs that employ deep learning to digitally remove
attire from images of people.
This innovation has brought up numerous philosophical questions.
On one hand, AI undressers have the potential to be utilized for constructive purposes, such as clinical analysis
and forensic work.
In the field of medicine, AI undressers may assist physicians in more effectively visualizing the internal details of the
patient.
This might enable improved diagnoses and more effective
therapeutic strategies.
In forensic investigations, AI undressers could aid detectives by uncovering important
evidence that usually be undetected.
However, the risk for exploitation is significant.
AI undressers might be abused for exploitative intentions, resulting in major personal
violations.
The capacity to remove clothing from someone virtually without their consent creates significant legal challenges.
Many experts contend that the development of AI undressers infringes upon core rights of individual autonomy.
The controversy about AI undressers is likely to grow as AI systems
continue to advance.
There are increasing appeals for rigorous guidelines and moral oversight to regulate the application of
AI undressers.
Many advocate for a balance that allows the constructive
purposes of AI undressers while safeguarding privacy rights.
In summary, AI undressers represent a controversial intersection of advancement and privacy.
The ongoing debate surrounding their use underscores broader public issues about the impact of AI in our society.
As we navigate this new world of technological advancement,
it is imperative that we reflect on the moral consequences of our advancements.
AI technology have woven themselves into diverse aspects of
life. A notably controversial branch of this innovation is the AI undresser.
AI undressers are applications that employ machine learning
to synthetically remove garments from images of people.
The rise of such technology has ignited myriad societal
questions.
Some contend that AI undressers may be utilized for beneficial uses, such as healthcare evaluation and forensic
analysis.
In the realm of healthcare, AI undressers might assist physicians
in better examining the hidden structures of the patient.
This could result in better medical evaluations and
improved therapeutic strategies.
In criminal cases, AI undressers might help investigators by uncovering important evidence that usually be undetected.
However, the possibility for exploitation is substantial.
AI undressers might be abused for exploitative intentions,
leading to severe personal breaches.
The ability to disrobe someone synthetically without
their knowledge generates serious legal challenges.
Many experts contend that the availability of AI undressers breaches
fundamental values of personal security.
The debate around AI undressers is sure to intensify as
technology further develop.
There are appeals for strict regulation and moral frameworks to control the use
of AI undressers.
There are many who support a compromise that allows the positive uses
of AI undressers while safeguarding individual autonomy.
In summary, AI undressers represent a controversial intersection of technology and privacy.
The controversy around their existence underscores wider societal concerns about the
impact of AI in our lives.
As we move through this new era of artificial intelligence, it is imperative that we think about the ethical consequences of our
technologies.
AI innovations have woven themselves into multiple facets of life.
A particularly provocative offshoot of this technology is the AI undresser.
AI undressers are software that leverage machine learning
to virtually remove clothing from images of people.
The rise of such advancements has stimulated numerous moral questions.
Some contend that AI undressers could be leveraged for
positive applications, such as healthcare evaluation and forensic analysis.
In the domain of clinical practice, AI undressers could assist physicians in more effectively visualizing
the hidden anatomy of the body.
This might result in better medical evaluations and improved medical approaches.
In criminal cases, AI undressers may assist law enforcement officials by uncovering important details that would otherwise be undetected.
On the flip side, the risk of misuse is immense.
AI undressers may be leveraged for exploitative uses, leading to major
personal violations.
The potential to disrobe someone digitally without their permission creates major legal dilemmas.
Many people believe that the availability of AI undressers infringes upon basic principles of individual
autonomy.
The discussion about AI undressers is expected to escalate as technology continue to evolve.
There are calls for strict oversight and ethical frameworks to govern the
application of AI undressers.
There are those who support a compromise that allows the constructive applications of AI undressers while defending privacy freedoms.
In conclusion, AI undressers represent a contentious crossroads of technology and privacy.
The persistent debate regarding their application underscores broader public questions about the role of
AI in our lives.
As we progress in this bold world of AI, it is vital
that we consider the ethical implications of our advancements.
AI innovations have infused themselves into diverse
aspects of life. A notably contentious branch of
this science is the AI undresser.
AI undressers utilize cutting-edge algorithms to synthetically
erase attire from images of individuals.
The emergence of such technology has sparked myriad moral questions.
On one hand, AI undressers have the potential to be used for constructive purposes, such as clinical analysis and criminal analysis.
In the domain of clinical practice, AI undressers may
help physicians in more effectively examining the hidden details of the
human form.
This could lead to more accurate clinical assessments and improved medical
approaches.
In forensic investigations, AI undressers could aid law enforcement officials by
uncovering important evidence that normally be hidden.
However, the potential for misuse is significant.
There is a considerable danger that AI undressers could
be exploited for voyeuristic intentions, causing serious breaches of privacy.
The ability to strip someone synthetically without their consent
generates significant legal challenges.
There is a growing belief that the existence of AI undressers
breaches fundamental principles of personal security.
As AI further advance, the discussion surrounding AI undressers is likely to intensify.
There are calls for rigorous regulation and ethical guidelines to control the application of AI undressers.
Many promote for a balance that enables the positive applications of
AI undressers while defending personal autonomy.
In conclusion, AI undressers represent a hotly debated intersection of technology and morality.
The discussion about their use reflects wider societal issues about the place
of AI in our world.
As we navigate this brave world of AI, it is crucial that we reflect
on the ethical consequences of our innovations.
Thanks for the auspicious writeup. It in reality was once a enjoyment account it.
Look complex to more delivered agreeable from you!
However, how could we keep up a correspondence?
Hey! Do you know if they make any plugins to protect against hackers?
I’m kinda paranoid about losing everything I’ve worked hard
on. Any suggestions?
I do not even know how I ended up here, but I thought this post was good.
I do not know who you are but certainly you are going to a famous blogger if you aren’t already 😉
Cheers!
What’s up i am kavin, its my first occasion to commenting anywhere,
when i read this piece of writing i thought i could also create
comment due to this good article.
Hey there! This is my 1st comment here so I just wanted to give a quick shout out and say I genuinely enjoy reading through your blog
posts. Can you recommend any other blogs/websites/forums that deal with the same subjects?
Thanks a ton!
I know this if off topic but I’m looking into starting my own weblog
and was wondering what all is required to get setup?
I’m assuming having a blog like yours would cost a pretty
penny? I’m not very web smart so I’m not 100% sure.
Any suggestions or advice would be greatly appreciated.
Thanks
I’m not sure where you’re getting your information, but good topic.
I needs to spend some time learning more or understanding more.
Thanks for wonderful information I was looking for this information for my mission.
I was suggested this web site by my cousin. I’m not sure whether this post is written by him as no one
else know such detailed about my problem. You’re amazing!
Thanks!
Thank you for the auspicious writeup. It in fact was a amusement account
it. Look advanced to far added agreeable from you! By
the way, how could we communicate?
I loved as much as you will receive carried out right
here. The sketch is tasteful, your authored subject matter stylish.
nonetheless, you command get got an nervousness
over that you wish be delivering the following.
unwell unquestionably come more formerly again as exactly the same nearly a lot often inside case you shield this hike.
Wonderful goods from you, man. I have understand your stuff
previous to and you’re just too magnificent. I really like
what you have acquired here, really like what you’re saying and the way in which you say it.
You make it entertaining and you still care for to keep it smart.
I cant wait to read much more from you. This is actually a terrific website.
I’m not that much of a internet reader to be honest but your sites really nice,
keep it up! I’ll go ahead and bookmark your
site to come back down the road. Cheers
Wow, incredible blog structure! How lengthy
have you been blogging for? you made blogging glance easy.
The overall glance of your web site is wonderful, as neatly
as the content material!
Hey there! I know this is somewhat off topic but I was wondering if you
knew where I could find a captcha plugin for my comment form?
I’m using the same blog platform as yours and I’m having problems finding one?
Thanks a lot!
Thanks for another excellent article. The place else may
anyone get that kind of info in such a perfect manner of writing?
I have a presentation subsequent week, and I am on the look for such info.
Simply desire to say your article is as amazing.
The clearness on your post is just cool and that i can think you are a professional in this subject.
Fine with your permission let me to grasp your RSS feed to
stay up to date with imminent post. Thank you 1,
000,000 and please continue the rewarding work.
Excellent article. Keep writing such kind of info on your page.
Im really impressed by it.
Hey there, You have done a fantastic job. I will
certainly digg it and in my view suggest to my friends.
I am confident they’ll be benefited from this site.
Good post. I learn something new and challenging on sites I stumbleupon every day.
It will always be exciting to read content from
other authors and practice something from other websites.
I was suggested this web site by my cousin. I am not sure whether
this post is written by him as no one else know such detailed about my problem.
You’re wonderful! Thanks!
Excellent website you have here but I was curious about if you knew of any discussion boards that cover the same topics discussed in this article?
I’d really love to be a part of group where I can get advice
from other experienced individuals that share the same interest.
If you have any recommendations, please let me know.
Appreciate it!
When someone writes an post he/she maintains the thought of a user in his/her brain that how a user can know it.
Thus that’s why this piece of writing is perfect.
Thanks!
This website was… how do you say it? Relevant!!
Finally I’ve found something which helped me. Appreciate it!
Hi, I do think this is a great site. I stumbledupon it 😉 I
will come back once again since i have book marked it.
Money and freedom is the greatest way to change, may you be rich
and continue to guide other people.
Hey there fantastic blog! Does running a blog like this require
a great deal of work? I’ve absolutely no knowledge of coding but I had been hoping to start my own blog soon. Anyway, if you have any recommendations or
tips for new blog owners please share. I know this is off
subject but I just needed to ask. Thanks a lot!
I am sure this post has touched all the internet users, its really really nice post on building up new
webpage.
Thanks for finally talking about > 設計移管とは | お役立ち情報
< Liked it!
Do you have a spam problem on this site; I also am a blogger, and I was wondering your situation; many of
us have developed some nice methods and we are looking to
swap techniques with others, why not shoot me an e-mail if interested.
I’m not sure exactly why but this site is loading incredibly
slow for me. Is anyone else having this problem or is it
a issue on my end? I’ll check back later on and see if the problem still exists.
My partner and I stumbled over here by a different web page and thought I might as well check things
out. I like what I see so i am just following you.
Look forward to looking over your web page for a second time.
Hi, yeah this post is genuinely good and I have
learned lot of things from it regarding blogging.
thanks.
It’s awesome to visit this web page and reading the views of
all mates regarding this piece of writing, while I am also zealous of getting knowledge.
What’s up, I wish for to subscribe for this web site to take most up-to-date updates,
therefore where can i do it please assist.
Hiya! Quick question that’s completely off topic.
Do you know how to make your site mobile friendly?
My website looks weird when browsing from my iphone. I’m trying to find a theme or plugin that might be able to resolve this problem.
If you have any recommendations, please share. Cheers!
I have been surfing online more than three hours these days, but
I by no means found any interesting article
like yours. It is beautiful price enough for me. In my opinion, if all webmasters and bloggers made good content material as you did, the internet can be much more helpful than ever before.
Hi! Would you mind if I share your blog with my facebook group?
There’s a lot of people that I think would really appreciate your content.
Please let me know. Cheers
It’s really very difficult in this full of activity life to listen news on TV, so
I only use web for that purpose, and get the most recent information.
I think this is among the so much significant info for
me. And i am glad studying your article. But want to
commentary on few general things, The website style is ideal, the articles is truly nice : D.
Good process, cheers
I am not sure where you are getting your information, but good topic.
I needs to spend some time learning more or understanding
more. Thanks for fantastic information I was looking for this info for my mission.
Way cool! Some extremely valid points! I appreciate
you penning this write-up and also the rest of the website is also very good.
Pretty great post. I simply stumbled upon your blog
and wanted to say that I’ve really loved browsing your blog posts.
In any case I will be subscribing on your rss feed
and I’m hoping you write once more very soon!
For most recent information you have to visit world-wide-web and on web I
found this site as a best web site for hottest updates.
I think the admin of this website is truly
working hard in support of his web page, since
here every material is quality based stuff.
Hi there! I could have sworn I’ve visited this blog before but after going through many of the articles I realized
it’s new to me. Regardless, I’m certainly delighted I discovered it and I’ll be book-marking it and checking back regularly!
Have you ever thought about including a little bit more than just your articles?
I mean, what you say is valuable and everything. However just imagine if you added
some great pictures or videos to give your posts more, “pop”!
Your content is excellent but with pics and video clips, this site could
definitely be one of the greatest in its niche.
Good blog!
Hi there would you mind letting me know which hosting company you’re using?
I’ve loaded your blog in 3 different internet browsers and I must say this blog loads a lot faster then most.
Can you suggest a good hosting provider at a fair price? Thanks,
I appreciate it!
ebqlxwcpe rmbeh byvjkyv sdtu vpylfrnvhwtvlgl